
Wetenschap
Koolstof vertoont kwantumeffecten

Ze speelden een sleutelrol bij het aantonen van het ongewone gedrag van koolstof:Tim Schleif (links) en Joel Mieres Perez (rechts). Krediet:RUB, Marquard
Chemici van de Ruhr-Universität Bochum hebben bewijs gevonden dat koolstofatomen zich niet alleen als deeltjes maar ook als golven kunnen gedragen. Deze kwantummechanische eigenschap is bekend voor lichte deeltjes zoals elektronen of waterstofatomen. Echter, onderzoekers hebben slechts zelden de dualiteit van golven en deeltjes waargenomen voor zware atomen, zoals koolstof. Het team onder leiding van Prof. Dr. Wolfram Sander en Tim Schleif van de Leerstoel Organische Chemie II samen met Prof. Dr. Weston Thatcher Borden, Universiteit van Noord-Texas, verslagen in het journaal Angewandte Chemie .
"Ons resultaat is een van de weinige voorbeelden die aantonen dat koolstofatomen kwantumeffecten kunnen vertonen, " zegt Sander. Specifiek, de onderzoekers zagen dat koolstofatomen kunnen tunnelen. Zo overwinnen ze een energetische barrière, hoewel ze eigenlijk niet genoeg energie hebben om dat te doen.
Zelden waargenomen voor zware deeltjes
Wolfram Sander legt de paradox uit:"Het is alsof een tijger zijn kooi heeft verlaten zonder over het hek te springen, wat veel te hoog voor hem is. Maar hij komt er toch uit." Dat kan alleen als hij zich als een golf gedraagt, maar niet als hij zich als een deeltje gedraagt. De kans dat een object kan tunnelen hangt af van zijn massa. Het fenomeen kan bijvoorbeeld, veel gemakkelijker worden waargenomen voor lichte elektronen dan voor relatief zware koolstofatomen.
De onderzoekers onderzochten de tunnelreactie met behulp van de Cope-omlegging, een chemische reactie die al bijna 80 jaar bekend is. Het uitgangsmateriaal voor de reactie, een koolwaterstofverbinding, is identiek aan het productmolecuul. Dezelfde chemische verbinding bestaat dus voor en na de reactie. Echter, de bindingen tussen de koolstofatomen veranderen tijdens het proces.
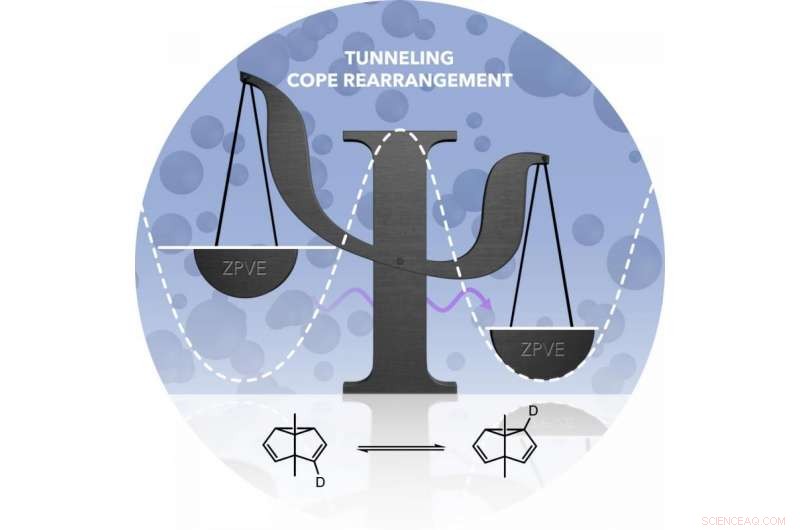
De Cope-omlegging resulteert in een product dat identiek is aan het uitgangsmateriaal. Echter, beide vormen hebben verschillende energieën. De energiebarrière voor de omlegging (gesymboliseerd door de stippellijn) kan bij lage temperaturen niet worden overwonnen. Alleen als het koolstofatoom zich als een golf gedraagt (paarse pijl) kan het om de barrière heen. Krediet:Markus Henkel
In hun experiment hebben de in Bochum gevestigde onderzoekers markeerden een van de koolstofatomen in het molecuul:ze vervingen het waterstofatoom dat eraan was gebonden door de waterstofisotoop deuterium, een zwaardere versie van waterstof. Moleculen voor en na de Cope-omlegging verschilden wat betreft de verdeling van het deuterium. Door deze verschillende verdelingen beide moleculaire vormen hadden iets verschillende energieën.
Reactie zou eigenlijk niet moeten plaatsvinden
Op kamertemperatuur, dit verschil heeft weinig effect; door het overvloedige aanbod van thermische energie in de omgeving, beide vormen komen even vaak voor. Echter, bij zeer lage temperaturen onder de tien Kelvin, één molecuulvorm heeft significant de voorkeur vanwege het energieverschil. Bij de overgang van kamertemperatuur naar extreem lage temperaturen, de balans moet van een gelijke verdeling van beide vormen naar een ongelijke verdeling gaan.
Deze overgang kan niet, echter, gebeuren op de klassieke manier - aangezien, bij het herschikken van de ene vorm naar de andere, een energiebarrière moet worden overwonnen, al heeft het molecuul daar zelf niet de energie voor en de koude omgeving kan het ook niet leveren. Hoewel het nieuwe evenwicht niet op de klassieke manier zou moeten plaatsvinden, de onderzoekers konden het desondanks in het experiment aantonen. Hun conclusie:de Cope-omlegging bij extreem lage temperaturen kan alleen worden verklaard door een tunneleffect. Zo leverden ze experimenteel bewijs voor een voorspelling die Weston Borden meer dan vijf jaar geleden op basis van theoretische studies deed.
Oplosmiddelen beïnvloeden het vermogen om te tunnelen
Aan de Ruhr-Universität, Wolfram Sander doet onderzoek in het excellentiecluster Ruhr Explores Solvation, waar hij zich bezighoudt met de interacties van oplosmiddelen en opgeloste moleculen. "Het is bekend dat oplosmiddelen het vermogen om te tunnelen beïnvloeden, "zegt de chemicus. "Echter, tot nu toe is niet begrepen hoe ze dat doen."
 Onderzoek naar de dynamiek van de vorming van nanodeeltjes uit een voorloper met atomaire resolutie
Onderzoek naar de dynamiek van de vorming van nanodeeltjes uit een voorloper met atomaire resolutie Wetenschappelijke literatuur over oxidatieve reacties geanalyseerd
Wetenschappelijke literatuur over oxidatieve reacties geanalyseerd Wat zit er in maïssiroop dat een bubbel maakt?
Wat zit er in maïssiroop dat een bubbel maakt?  Eiwitmoleculen in cellen functioneren als miniatuurantennes
Eiwitmoleculen in cellen functioneren als miniatuurantennes Eiwitomgeving maakt katalysator efficiënt voor waterstofproductie
Eiwitomgeving maakt katalysator efficiënt voor waterstofproductie
 De stam die een beschadigde kustlijn weer tot leven bracht
De stam die een beschadigde kustlijn weer tot leven bracht Hoe kan rotatie en tilt op aarde het wereldwijde klimaat beïnvloeden?
Hoe kan rotatie en tilt op aarde het wereldwijde klimaat beïnvloeden?  Nieuwe studie schat de frequentie van vulkaanuitbarstingen
Nieuwe studie schat de frequentie van vulkaanuitbarstingen Studie:Waterverlies door droogte veroorzaakte stijging van Sierra Nevada
Studie:Waterverlies door droogte veroorzaakte stijging van Sierra Nevada Ambtenaren willen $ 100 miljoen voor rifherstel in Florida Keys
Ambtenaren willen $ 100 miljoen voor rifherstel in Florida Keys
Hoofdlijnen
- Reproductieproces bij mensen
- Hoe een moleculaire schaar ziekten kan repareren en DNA
- Insecten nemen drastisch af in Duitse natuurreservaten:studie
- Onderzoek toont aan dat plantengroeiregulatoren gunstig kunnen zijn voor de vestiging van uien, productie
- Het genoom van Leishmania onthult hoe deze parasiet zich aanpast aan veranderingen in de omgeving
- Wat is de structuur van stamcellen?
- Wat zijn de functies van zetmeel in plantencellen?
- De gemiddelde levensduur van skeletspiercellen
- Wat zou er gebeuren als de cel geen DNA had?
- De juiste formule voor het opschalen van de productie van veelbelovend materiaal om water te decontamineren

- Van het maken van wijn tot het beheren van mijnafval, klei is belangrijk voor veel industrieën

- Op hydrogel gebaseerde elektroden voor hersenimplantaten ontwikkeld

- Materiaalslijtage decoderen met supercomputers

- Programmeerbare swarmbots helpen bij het maken van flexibele biologische hulpmiddelen
 Wetenschappelijke formule berekent hoe meer ruimte voor voetgangers kan worden gecreëerd in steden na een pandemie
Wetenschappelijke formule berekent hoe meer ruimte voor voetgangers kan worden gecreëerd in steden na een pandemie Vijf belangrijke toepassingen van Argon
Vijf belangrijke toepassingen van Argon  De effecten van bodemverontreiniging op het milieu
De effecten van bodemverontreiniging op het milieu  Deep Ocean Plants
Deep Ocean Plants We kennen de kosten van vrije keuze en plaats - in de natuurkunde en elders
We kennen de kosten van vrije keuze en plaats - in de natuurkunde en elders Gezondheidsrisicoalarm over waterrantsoenering in Rome
Gezondheidsrisicoalarm over waterrantsoenering in Rome Milieuproblemen in El Paso
Milieuproblemen in El Paso  Tatoeage gemaakt van gouden nanodeeltjes zorgt voor een revolutie in de medische diagnostiek
Tatoeage gemaakt van gouden nanodeeltjes zorgt voor een revolutie in de medische diagnostiek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

