
Wetenschap
Programmeerbare swarmbots helpen bij het maken van flexibele biologische hulpmiddelen
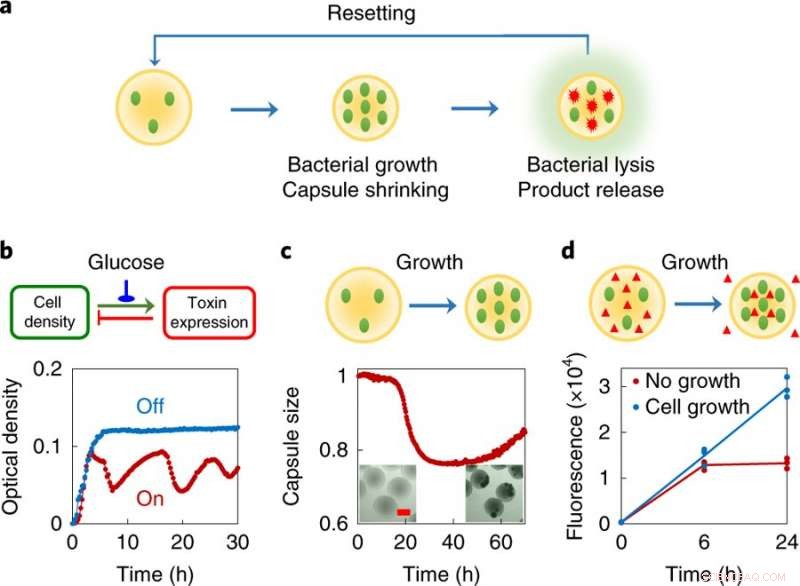
een, Concept ontwerp, elke swarmbot bestaat uit een kleine populatie van gemanipuleerde bacteriën ingekapseld in polymere microcapsules. Deze bacteriën zijn ontworpen om gedeeltelijke lysis te ondergaan bij een voldoende hoge lokale dichtheid. Omgekeerd, het omhulmateriaal zal krimpen als reactie op de veranderende chemische omgeving veroorzaakt door celgroei. Als de bacteriën geprogrammeerde autolyse ondergaan, ze geven intracellulaire eiwitten af. De verknoopte polymere capsules vangen de levende cellen en grote brokstukken binnenin, en het bijbehorende krimpen vergemakkelijkt de export van eiwitproducten uit de capsules. Het systeem wordt gereset door bij te vullen met vers medium. B, Geprogrammeerde autonome lysis door het ePop-circuit (boven, circuit logica; onderkant, experimentele gegevens). Een dichtheidsafhankelijke toename van het aantal kopieën van het plasmide leidt tot een toename van de expressie van een toxine (het E-eiwit van faag φX174). Bij voldoende hoge concentratie het E-eiwit veroorzaakt cellysis, waardoor de celdichtheid afneemt. Wanneer ingeschakeld (rode curve), het circuit leidde tot een verminderde kweekdichtheid van MC4100Z1(ePop), gecompenseerd door groei en gereguleerd doden. Met het oog op het algehele systeemontwerp, het genereren van trillingen is niet essentieel. Het circuit kan worden uitgeschakeld (blauwe curve) door 1% glucose toe te voegen. Het experiment werd meer dan drie keer onafhankelijk herhaald met vergelijkbare resultaten. C, Krimpen van capsules als reactie op groei van ingekapselde bacteriën (top, schematisch; onderkant, experimentele gegevens). MC4100Z1 (ePop / GFP) -cellen werden ingekapseld in chitosan-capsules en gekweekt in M9. Alle gegevens werden genormaliseerd naar de waarde op tijdstip nul. inzet, microscopiebeelden van MSB's na 0 h (links) en 48 h (rechts). Schaalbalk, 200 m. Het experiment werd meer dan drie keer onafhankelijk herhaald met vergelijkbare resultaten. NS, Door groei gemedieerde krimp van de capsule vergemakkelijkt de export van macromoleculen uit de capsules (boven, schematisch; onderkant, experimentele gegevens). MG1655-cellen en dextran-rhodamine (molecuulgewicht ≈ 70, 000 g mol−1) werden ingekapseld in de chitosan-capsules en gekweekt in M9. Capsules werden behandeld met of zonder ampicilline (100 μg ml−1). krimpende capsules, veroorzaakt door bacteriegroei in afwezigheid van antibiotica, leidde tot een ~ 2,25-voudige toename van de rhodamine-fluorescentie in vergelijking met niet-krimpende capsules na 24 h, die niet-groeiende bacteriën bevatten (onderdrukt door antibiotica). Het experiment werd in drievoud uitgevoerd als onafhankelijke biologische replica's en de gegevens worden weergegeven als individuele stippen, de lijn geeft het gemiddelde aan. Credit: Natuur Chemische Biologie (2019). DOI:10.1038/s41589-019-0357-8
Biomedische ingenieurs van Duke University hebben een nieuw platform ontwikkeld om biologische medicijnen te maken met behulp van speciaal ontworpen bacteriën die barsten en nuttige eiwitten vrijgeven wanneer ze merken dat hun capsule te vol raakt.
Het platform steunt op twee hoofdcomponenten:de gemanipuleerde bacteriën, genaamd "swarmbots, " die zijn geprogrammeerd om de dichtheid van hun leeftijdsgenoten in hun container te voelen, en het biomateriaal dat de swarmbots opsluit, een poreuze capsule die kan krimpen als reactie op veranderingen in de bacteriepopulatie. Als het krimpt, de capsule perst gerichte eiwitten uit die door de in gevangenschap levende bacteriën zijn gemaakt.
Dit op zichzelf staande platform zou het voor onderzoekers gemakkelijker kunnen maken om analyseren en zuiveren van diverse biologische producten voor gebruik in kleinschalige bioproductie.
Het onderzoek verscheen op 16 september online in het tijdschrift Natuur Chemische Biologie .
Bacteriën worden vaak gebruikt om biologische, dat zijn producten zoals vaccins, gentherapieën en eiwitten die zijn gemaakt of gesynthetiseerd uit biologische bronnen. Momenteel, dit proces omvat een reeks geavanceerde stappen, waaronder celkweek, eiwitisolatie en eiwitzuivering, die elk een delicate infrastructuur vereisen om efficiëntie en kwaliteit te garanderen. Voor industriële operaties, deze stappen worden op grote schaal uitgevoerd. Hoewel dit helpt bij het produceren van grote hoeveelheden van bepaalde moleculen, deze opzet is niet flexibel of financieel haalbaar wanneer onderzoekers kleine hoeveelheden van diverse biologische geneesmiddelen moeten produceren of in omgevingen met beperkte middelen moeten werken.
De nieuwe technologie is ontwikkeld door Lingchong You, een hoogleraar biomedische technologie aan de Duke University, en een voormalig postdoctoraal onderzoeker van Duke, Zhuojun Dai, nu een universitair hoofddocent aan het Shenzhen Institute of Advanced Technologies. In de nieuwe studie ze laten zien hoe hun nieuwe platform de communicatie tussen swarmbots en hun capsule gebruikt om een veelzijdige productie te realiseren, analyse en zuivering van diverse eiwitten en eiwitcomplexen.
In een eerdere proof of concept, Jij en zijn team hebben een niet-pathogene stam van E. coli-bacteriën ontwikkeld om een tegengif voor antibiotica te produceren wanneer de bacteriën een bepaalde dichtheid bereikten. Deze swarmbots werden vervolgens opgesloten in een capsule, die baadde in antibiotica. Als een bacterie de capsule verliet, werd deze vernietigd, maar als het in de container bleef waar de bevolkingsdichtheid hoog was, het heeft het overleefd.
"Onze eerste studie toonde in wezen eenrichtingscommunicatie aan, waar de cellen de omgeving in de capsule konden voelen, maar de omgeving reageerde niet op de cellen, "zei jij. "Nu, we hebben tweerichtingscommunicatie - de geconstrueerde swarmbots kunnen nog steeds hun dichtheid en hun opsluiting voelen, maar we hebben een materiaal geïntroduceerd dat kan reageren wanneer de bacteriële populatie erin verandert. Het is alsof de twee componenten met elkaar praten, en samen geven ze je heel dynamisch gedrag."
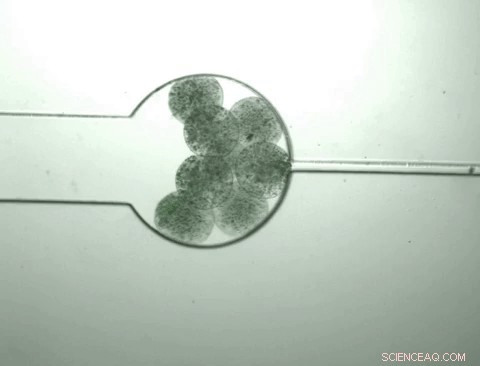
Capsules met op maat gemaakte bacteriën die 'swarmbots' worden genoemd, groeien en krimpen als reactie op de chemische omgeving die ze bevatten. De swarmbots voelen dat hun eigen bevolkingsdichtheid een bepaald niveau heeft bereikt en splijten open om hun inhoud vrij te geven, inclusief een eiwit waarvoor ze zijn ontwikkeld. De capsule krimpt dan en het proces wordt hervat wanneer voedingsstoffen worden toegevoegd. Krediet:Zhuojun Dai
Zodra de populatie in de capsule een bepaalde dichtheid bereikt, de bacteriën beginnen te 'knallen', ' het vrijgeven van al hun cellulaire inhoud, inclusief het eiwitproduct van belang. Tegelijkertijd, deze bacteriële groei verandert de chemische omgeving in de capsule, waardoor het krimpt. Naarmate het krimpt, het perst het eiwit dat vrijkomt uit de barstende cellen eruit terwijl de bacteriën en celresten in de capsule worden gehouden.
Zodra de eiwitten zijn verzameld, onderzoekers kunnen een voedingssupplement aan het gerecht toevoegen als een signaal om de capsules te vergroten. Hierdoor wordt de binnenomgeving gereset en kunnen de bacteriën weer beginnen te groeien, het proces opnieuw starten. Volgens jou, deze cyclus kan tot een week worden herhaald.
Om de aanpak bruikbaar te maken voor bioproductie, het team voegde de capsules toe aan een microfluïdische chip, die een kamer bevatte waarin ze konden detecteren en kwantificeren welke eiwitten werden vrijgegeven. Dit kan worden vervangen door een zuiveringskamer om de eiwitten voor te bereiden voor gebruik in biologische geneesmiddelen.
"Het is een heel compact proces. Je hebt geen elektriciteit nodig, en je hebt geen centrifuge nodig om deze eiwitten te produceren en te isoleren, " zei u. "Het maakt dit een goed platform voor bioproductie. Je bent in staat om tegen lage kosten een bepaald type medicijn in een zeer compact formaat te produceren, en het is gemakkelijk te leveren. Daarbovenop, dit platform biedt een gemakkelijke manier om meerdere eiwitten tegelijk te produceren."
Volgens jou, dit gebruiksgemak heeft het team in staat gesteld om te produceren, kwantificeren en zuiveren van meer dan 50 verschillende eiwitten in samenwerking met het lab van Ashutoshi Chilkoti, Alan L. Kaganov Professor en voorzitter van de afdeling Biomedical Engineering aan Duke. Ze hebben ook onderzocht hoe hun platform de aanmaak van eiwitcomplexen kan vereenvoudigen, dat zijn structuren gemaakt van meerdere eiwitten.
Over een proof-of-concept-experiment om een vetzuursyntheseroute te produceren uit meerdere enzymen, "we konden zeven versies van onze microbiële swarmbots gebruiken, die elk waren geprogrammeerd om een ander enzym te produceren, "zei jij. "Meestal, om een metabolische route te produceren die je nodig hebt om de toeleveringsketen in evenwicht te brengen, wat zou kunnen betekenen dat de expressie van het ene enzym wordt opgereguleerd en de expressie van een ander wordt verlaagd. Met ons platform hoef je dat niet te doen, je hoeft alleen de juiste verhouding van swarmbots in te stellen."
"Deze technologie is ongelooflijk veelzijdig, " zei hij. "Dat is een mogelijkheid waarvan we willen profiteren."
Hoofdlijnen
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- Wat is het verschil tussen erfelijke en milieudefecten?
- Kunstmatige nesten zijn bedoeld om het broedsucces van de schuwe albatros te vergroten
- Hoe lang kunnen virussen op oppervlakken leven?
- Kunnen we onze organen klonen voor gebruik bij een transplantatie?
- Hoe MRNA naar TRNA te vertalen
- Welke Cell Organelle slaat DNA op en synthetiseert RNA?
- Wetenschappers passen CRISPR aan om diabetes epigenetisch te behandelen, nierziekte, spierdystrofie
- What Influences Phenotype?
 Oude grotafzettingen onthullen onze klimaattoekomst
Oude grotafzettingen onthullen onze klimaattoekomst Gouverneur van Maryland veto tegen wetsvoorstel om oesterreservaten permanent te beschermen tegen oogst
Gouverneur van Maryland veto tegen wetsvoorstel om oesterreservaten permanent te beschermen tegen oogst 3D-simulator voor stressanalyse voor ultrakleine siliciumapparaten onthuld
3D-simulator voor stressanalyse voor ultrakleine siliciumapparaten onthuld Hoe de grenzen van de geest de menselijke taal vormen
Hoe de grenzen van de geest de menselijke taal vormen Onderzoekers ontdekken materiaal dat ooit een kwantumcomputer kan aandrijven
Onderzoekers ontdekken materiaal dat ooit een kwantumcomputer kan aandrijven Hoe olietank te berekenen Volume
Hoe olietank te berekenen Volume Water bestaat als twee verschillende vloeistoffen
Water bestaat als twee verschillende vloeistoffen Wat is CO2-gas?
Wat is CO2-gas?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com







