
Wetenschap
Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
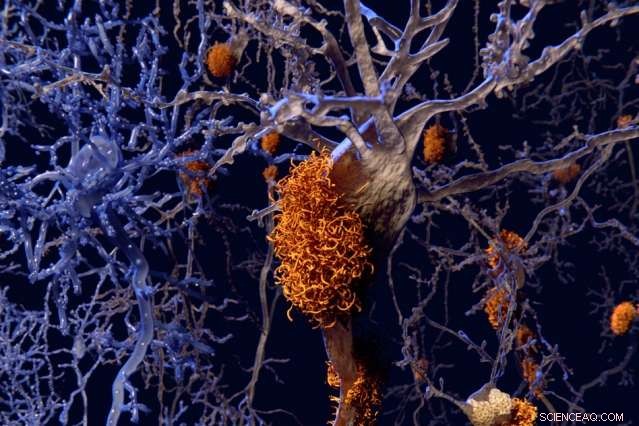
“Hoewel er veel hoge resolutie is geweest, structureel werk op atomair niveau op amyloïden door NMR in vaste toestand, mensen hebben de metaalbindende aspecten echt niet bestudeerd, ”, zegt professor Mei Hong. Krediet:Massachusetts Institute of Technology
Amyloïden zijn klompjes eiwitfragmenten die aan elkaar kleven om vezelige fibrillen te vormen, zoals de plaques die te zien zijn in de hersenen van Alzheimerpatiënten. Veel van deze eiwitten binden zich aan metalen zoals zink, maar de structuur van deze metaalgebonden eiwitten was moeilijk te bestuderen. Het belang van deze metalen voor de activiteit van amyloïden blijft dus een open vraag, wat des te verwarrender is omdat sommige amyloïden geassocieerd zijn met ziekte, maar andere niet.
Een team van MIT-chemici, werken met onderzoekers van de Universiteit van Californië in San Francisco (UCSF) en de Universiteit van Syracuse, heeft nu de structuur ontcijferd van een amyloïde die aan zink bindt. Hun aanpak, gebaseerd op nucleaire magnetische resonantie (NMR), kan ook worden gebruikt om de structuren van extra metaalgebonden amyloïden te onthullen.
"Hoewel er veel hoge resolutie is geweest, structureel werk op atomair niveau op amyloïden door NMR in vaste toestand, mensen hebben de metaalbindende aspecten echt niet bestudeerd, " zegt Mei Hong, een MIT-professor in de chemie en een van de senior auteurs van het artikel, die verschijnt in de Proceedings van de National Academy of Sciences de week van 29 mei.
Onderzoekers van UCSF en Syracuse ontwierpen het amyloïde-eiwit om een specifieke reactie te katalyseren:het combineren van koolstofdioxide en water om bicarbonaat te vormen. De nieuw ontdekte structuur van het amyloïde werpt licht op hoe het eiwit deze functie vervult en hoe zink helpt bij de katalyse van de reactie.
Willem De Grado, een professor in de farmaceutische chemie aan de UCSF, is de andere senior auteur van de krant. MT-afgestudeerde student Myungwoon Lee is de hoofdauteur van het artikel.
Structuurbepaling
Hoewel amyloïden vaak worden geassocieerd met ziekten zoals de ziekte van Alzheimer en Parkinson, andere amyloïden hebben normale biologische functies.
De UCSF- en Syracuse-onderzoekers rapporteerden voor het eerst hun kunstmatige amyloïde in 2014. Hun doel was om een zeer eenvoudig metaalgebonden eiwit te produceren dat een chemische reactie zou kunnen katalyseren die nodig is voor het leven, in de hoop aan te tonen dat dergelijke eenvoudige metaalgebonden peptiden voorlopers zouden kunnen zijn van moderne enzymen. In dat blad, ze toonden aan dat het peptide, die bestaat uit zeven aminozuren gebonden aan een zinkion, zou de omzetting van kooldioxide en water in bicarbonaat even efficiënt kunnen katalyseren als het enzym koolzuuranhydrase, die deze reactie in levende cellen uitvoert en ook zink vereist.
"Het is aannemelijk dat zeer kleine peptiden die metaalionen dragen chemie doen, en de evolutie van enzymactiviteiten kan zijn begonnen met deze kleine peptiden, ', zegt Hong.
De UCSF-onderzoekers ontwierpen hun peptide zo dat zijn actieve plaats, waar de chemische reactie plaatsvindt, zou die van koolzuuranhydrase nabootsen, die een zinkion heeft dat is vastgemaakt aan drie ketens van het aminozuur histidine. Echter, ze wisten niet de precieze structuur van de fibrillen gevormd door hun peptide, dat is waar Hong en haar MIT-collega's binnenkwamen.
Om de structuur te bepalen, het onderzoeksteam gebruikte een tweeledige benadering op basis van NMR-spectroscopie en bio-informatica, dat is een methode om computeralgoritmen te gebruiken om biologische gegevens te analyseren.
Met behulp van NMR, de onderzoekers bepaalden eerst dat de peptiden een lange fibrilketen vormen die uit lagen van structuren bestaat die bètabladen worden genoemd. Binnen elk bètablad, elke peptidestreng heeft twee histidinen die kunnen interageren met de volgende streng. Hun volgende doel was om te bepalen hoe de zinkionen in deze meerstrengige en meerlagige structuur passen.
NMR gebruikt de magnetische eigenschappen van atoomkernen om de structuren te onthullen van de moleculen die die kernen bevatten. In dit geval, de onderzoekers gebruikten NMR om signalen te analyseren van belangrijke stikstofatomen in de histidine-zijketens die interageren met zinkionen. Door deze signalen te vergelijken wanneer de amyloïden wel en niet aan zink gebonden waren, de onderzoekers stelden vast dat de helft van de histidinen elk één zinkatoom coördineren, terwijl de andere helft een interactie aangaat met elk twee zinkatomen. "De hoge concentratie histidinen die twee zinkionen overbrugt, is zeer ongebruikelijk, ', zegt Hong.
De onderzoekers gebruikten ook NMR om de hoeken van de bindingen te meten waardoor histidine kan interageren met zink, en vervolgens bioinformatica gebruikt om de mogelijke structuren te bepalen die consistent zijn met die configuraties. Hieruit bleek dat één zinkatoom tussen twee amyloïde-bèta-strengen zit, en het is gebonden aan één histidine-zijketen van boven en twee van onderen. Dit vormt een tetraëdrische structuur waarin drie histidinestikstoffen het zink op zijn plaats houden, terwijl één histidinestikstof ongebonden blijft.
vroege katalyse
De niet-gehechte histidinestikstof is vrij om te binden aan een watermolecuul, die nodig is om de door het zinkion gekatalyseerde reactie uit te voeren. Hong's medewerkers bij UCSF hebben eerder aangetoond dat dit amyloïde de vorming van bicarbonaat katalyseert met een snelheid die vergelijkbaar is met die van koolzuuranhydrase, ter ondersteuning van de theorie dat dit type eenvoudige amyloïde door vroege levensvormen zou kunnen zijn gebruikt om belangrijke reacties uit te voeren.
Hong is nu van plan om te beginnen met het bestuderen van de structuur van metaalgebonden amyloïden die betrokken zijn bij neurodegeneratieve ziekten. Van de amyloïden die betrokken zijn bij zowel de ziekte van Parkinson als de ziekte van Alzheimer is aangetoond dat ze zich binden aan metaalionen, inclusief zink en koper, maar hoe deze metalen de ziekten beïnvloeden is niet bekend, noch zijn hun structuren bepaald.
"Er zijn enkele moleculaire dynamica-simulaties geweest om te raden hoe metalen deze histidinen binden, maar er is geen hoge resolutie, onderzoek op atomair niveau van de coördinatiestructuur, ', zegt Hong.
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Bonddissociatie-energieën voor overgangsmetaalsiliciden nauwkeurig bepaald
Bonddissociatie-energieën voor overgangsmetaalsiliciden nauwkeurig bepaald De verrassende flexibiliteit van kristaloppervlakken vastleggen
De verrassende flexibiliteit van kristaloppervlakken vastleggen Visualisatie van moleculaire beweging van gesubstitueerd 9-fosfaanthraceen
Visualisatie van moleculaire beweging van gesubstitueerd 9-fosfaanthraceen Kleurrijke oplossing voor een knelpunt in de chemische industrie
Kleurrijke oplossing voor een knelpunt in de chemische industrie Herbruikbare stoffen maskers blijven na een jaar wassen goed, drogen
Herbruikbare stoffen maskers blijven na een jaar wassen goed, drogen
Hoofdlijnen
- Hoe planten hun zaden vormen
- Hoe celbrochures te maken
- Karkas van Noord-Atlantische rechtse walvis gespot in Massachusetts
- Eerste celkaart van 20, 000 cellen in zoogdierembryo
- Uit een grootschalig onderzoek blijkt dat veel geplande wegen in de tropen niet gebouwd mogen worden
- Gescheiden sinds de dinosauriërs, bamboe-etende lemuren, panda's delen gemeenschappelijke darmmicroben
- Hoe zijn schimmels en planten vergelijkbaar?
- Computersimulaties onthullen wortels van resistentie tegen geneesmiddelen
- Kenmerken van micro-organismen
- Nieuwe methode gebruikt fluorescentie om ziekteverwekkende vormen van eiwitten te identificeren
- Rad-onthullingen:toekomstige brandstofontwerpen van edele metalen

- Kijken naar atomen die bewegen in hybride perovskietkristallen onthult aanwijzingen voor het verbeteren van zonnecellen

- Een volledig organische protonenbatterij die wordt geactiveerd voor duurzame energieopslag
- Waterstofalarm voor waterstoflekdetectie op afstand

 Bewijs van waterbeweging gevonden in meteorieten die pas onlangs op aarde zijn gevallen
Bewijs van waterbeweging gevonden in meteorieten die pas onlangs op aarde zijn gevallen Hoe u het omgekeerde percentage berekent
Hoe u het omgekeerde percentage berekent  Zware sneeuwval veroorzaakt reischaos in Noord-Europa
Zware sneeuwval veroorzaakt reischaos in Noord-Europa Chicago zinkt. Dit is wat dat betekent voor Lake Michigan en de Midwest
Chicago zinkt. Dit is wat dat betekent voor Lake Michigan en de Midwest Radicalen splitsen
Radicalen splitsen Hoe openingen in het Antarctische zee-ijs het wereldwijde klimaat beïnvloeden
Hoe openingen in het Antarctische zee-ijs het wereldwijde klimaat beïnvloeden Stephen Hawkings-rolstoel, proefschrift te koop
Stephen Hawkings-rolstoel, proefschrift te koop Fotonische meta-oppervlakken bieden een nieuwe speeltuin voor twistronics
Fotonische meta-oppervlakken bieden een nieuwe speeltuin voor twistronics
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

