
Wetenschap
Wetenschappers ontcijferen het multi-domein, volledige structuur van de humane smoothened receptor
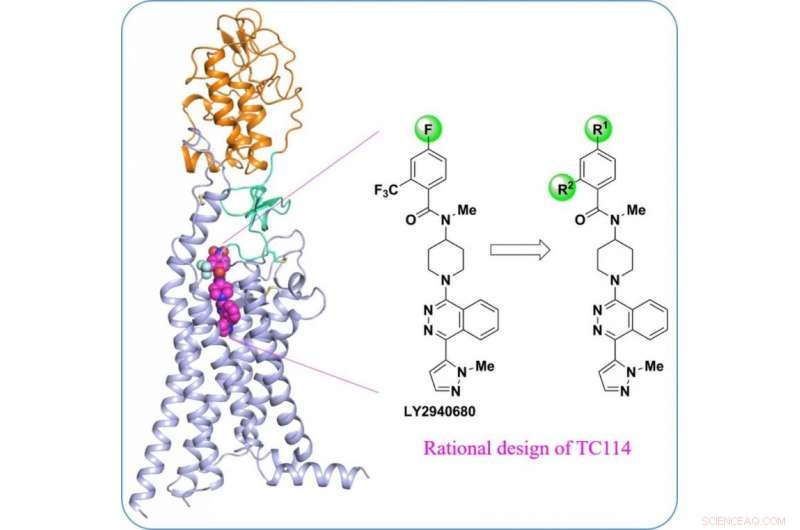
Structuur van multi-domein menselijke Smoothened receptor, een belangrijk medicijndoelwit voor kanker. Krediet:ShanghaiTech University
Een team van wetenschappers onder leiding van het iHuman Institute van ShanghaiTech University in samenwerking met Fudan University heeft de kristalstructuur met hoge resolutie van de multi-domein humane smoothened receptor bepaald. De resultaten illustreren de allosterische domein-domein interacties binnen de receptor, en hun rol bij een soepelere activering. Deze nieuwe bevindingen worden op 17 mei gepubliceerd, 2017 in Natuurcommunicatie , getiteld "Kristalstructuur van een multi-domein menselijke gladde receptor in complex met een superstabiliserende ligand, " door Zhang X-J et al.
Als een centrale speler in de Hedgehog-signaleringsroute die betrokken is bij embryonale ontwikkeling en tumorigenese, de smoothened receptor (SMO) is lang gezocht als medicijndoelwit voor tal van kankers. Geneesmiddelresistentie was echter een probleem vanwege mutaties in SMO. "De ontwikkeling van anti-SMO-geneesmiddelen van de volgende generatie zal worden vergemakkelijkt door inzicht te krijgen in de multidomeinregeling in de SMO-structuur", zei Fei Xu, Universitair docent bij iHuman Institute, ShanghaiTech-universiteit, en de hoofd corresponderende auteur van dit artikel. "Deze structuur stelt ons in staat om potentieel nieuwe ligandbindingsplaatsen en signaleringsmechanismen te identificeren."
"Om het multi-domein menselijke SMO-eiwit te stabiliseren, we hebben een reeks chemische gereedschapsverbindingen ontworpen", zei Houchao Tao, Onderzoeksdocent bij iHuman Institute. "TC114 is een sonde die de receptor aanzienlijk stabiliseert en vergrendelt in een enkele conformatie." Met verdere optimalisatie, Promovendus Xianjun Zhang loste de multi-domein SMO-structuur op gebonden aan TC114 op 2,9 angstrom met behulp van röntgenvrije elektronenlaser. "Deze structuur onthult het scharnierdomein dat een belangrijke modulerende rol kan spelen bij het verbinden van de domeinen, het verstrekken van hints voor de ontwikkeling van nieuwe modulatoren gericht op deze regio", zei Xianjun Zhang.
"Dit is mooi teamwork", zei Raymond Stevens, directeur van het iHuman Instituut, ShanghaiTech-universiteit, "chemie en biologie worden in deze wetenschap met elkaar verbonden om de structuur en functie van deze complexe multidomein-receptor te begrijpen. De kristalstructuur, beurtelings, opent nieuwe wegen voor het ontdekken van medicijnen."
 Zelfs zonder El Nino vorig jaar, Aarde blijft opwarmen
Zelfs zonder El Nino vorig jaar, Aarde blijft opwarmen Hoogleraar biologie onderzoekt rivierecologie op wereldschaal
Hoogleraar biologie onderzoekt rivierecologie op wereldschaal Onderzoek suggereert dat agressieve koolstofbelasting de VS kan helpen de doelstellingen in het akkoord van Parijs te halen
Onderzoek suggereert dat agressieve koolstofbelasting de VS kan helpen de doelstellingen in het akkoord van Parijs te halen Onderzoek onthult veranderingen in huishoudelijk waterverbruik tijdens lockdown
Onderzoek onthult veranderingen in huishoudelijk waterverbruik tijdens lockdown Brandweerlieden worstelen om vuur in Zuid-Californië te bedwingen
Brandweerlieden worstelen om vuur in Zuid-Californië te bedwingen
Hoofdlijnen
- Welke organismen voeren fotosynthese uit?
- Hoe transhumanisme werkt
- Een geprioriteerde lijst van invasieve uitheemse soorten die het milieu van het VK bedreigen
- Ponso helpen, enige overlevende van Chimpansee-eiland in I. Coast
- Albatrospopulaties nemen af door visserij en veranderingen in het milieu
- Waarom zijn mensen altruïstisch?
- Hoe krijgt bloed zuurstof?
- Bioreactoren op een chip vernieuwen beloften voor algenbiobrandstoffen
- Onderdelen van sperma
- Moleculen in collectieve extase

- Hoe de onthulling van de structurele ontwikkeling van zeolieten toekomstige synthetische ontwerpen ten goede zal komen

- Wetenschappers ontdekken lichaamsbeschermingsschild
- Door de bodem kijken kan boeren helpen om toekomstige droogtes het hoofd te bieden

- Zonnecellen met nieuwe interfaces

 Nieuwe aanpak voor het regelen van qubits via microgolfpulsen vermindert het foutenpercentage en verhoogt de efficiëntie
Nieuwe aanpak voor het regelen van qubits via microgolfpulsen vermindert het foutenpercentage en verhoogt de efficiëntie Laat de meisjes fluit spelen, jongens bash drums stereotypen
Laat de meisjes fluit spelen, jongens bash drums stereotypen Air Canada koopt touroperator Transat voor 520 miljoen dollar
Air Canada koopt touroperator Transat voor 520 miljoen dollar Vreemde stralen gecrowdsourcet op sociale media werpen licht op de verlichting van zwarte gaten
Vreemde stralen gecrowdsourcet op sociale media werpen licht op de verlichting van zwarte gaten Vijf dingen die u moet weten over het dieselgate-schandaal van VW
Vijf dingen die u moet weten over het dieselgate-schandaal van VW Wat zijn de voor- en nadelen van elektromagnetische energie Krachtbronnen?
Wat zijn de voor- en nadelen van elektromagnetische energie Krachtbronnen?  Vervuilingsvrije waterstof:doorbraak groene energie?
Vervuilingsvrije waterstof:doorbraak groene energie? Zelfmontage en kettingen van roterende magnetische deeltjes
Zelfmontage en kettingen van roterende magnetische deeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

