
Wetenschap
Naar een beter begrip van structuur-metabolismerelaties in humaan aldehydeoxidase (update)
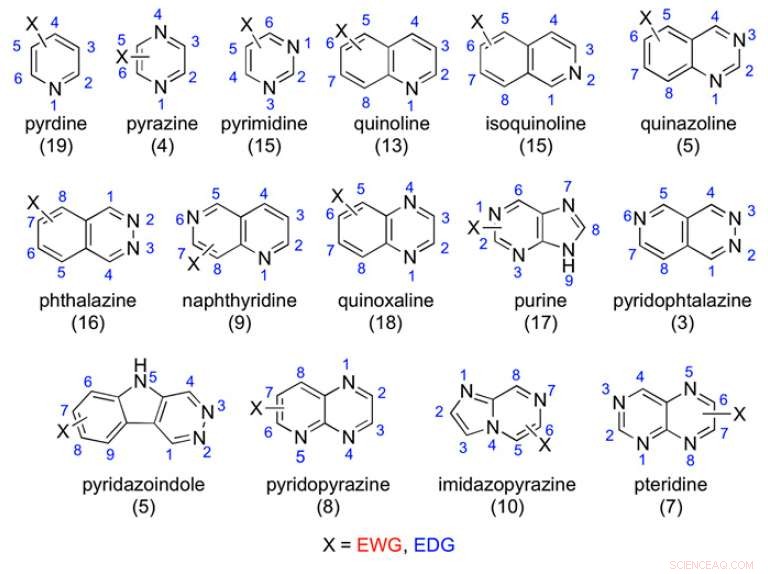
Voorbeelden van de bestudeerde aza-aromatische scaffolds:het aantal geteste verbindingen wordt tussen haakjes vermeld. Krediet:(c) Proceedings van de National Academy of Sciences (2017). DOI:10.1073/pnas.1618881114
(Phys.org) — Bij het ontwerpen van medicijnen gaat het om begeleid vallen en opstaan. Hoe het lichaam een bepaald medicijn metaboliseert, is belangrijk voor het bepalen van de werkzaamheid van het medicijn. Er zijn veel onderzoeken geweest om te begrijpen hoe xenobiotica interageren met cytochroom P450's, een belangrijke klasse van enzymen in het metabolisme van geneesmiddelen, maar er is weinig onderzoek gedaan om het metabolisme van aldehydeoxidase (AOX) te begrijpen. AOX, gelegen in de lever, speelt een belangrijke rol bij het metabolisme van geneesmiddelen; echter, veel potentiële medicijnen mislukken uiteindelijk tijdens onderzoeken in een laat stadium vanwege hun interactie met AOX.
Om de relatie tussen structuur en stofwisseling tussen functionele groepen en AOX beter te begrijpen en om algemene richtlijnen voor niet-cytochroom P450-geneesmiddelmetabolisme vast te stellen, onderzoekers van de Universiteit van Perguia in Italië voerden tests uit op 198 verbindingen met aza-aromatische steigers om te zien welke werden geoxideerd door AOX. Verder, ze testten 75 amidesteigers om te bepalen welke gehydrolyseerd waren. Ze ontdekten dat zowel elektronische factoren als sterische hinder de oriëntatie van het molecuul in de MoCo-actieve plaats beïnvloedden, die bepaalde of de verbinding werd gemetaboliseerd door AOX. Hun werk verschijnt in de Proceedings van de National Academy of Sciences .
AOX is een enzym dat zich in de lever bevindt en dat de neiging heeft aza-aromatische verbindingen te oxideren als een fase I-metaboliet. Studies hebben aangetoond dat AOX de ongesubstitueerde koolstof activeert ortho aan de stikstof op de aza-heterocyclus. Omdat dit de meest elektropositieve koolstof van de aromatische ring is, elektronendichtheid speelt waarschijnlijk een rol bij AOX-activering. Maar deze onderzoeken evenals anderen die kijken naar het AOX-metabolisme, waren gebaseerd op een klein aantal moleculen waardoor geen algemeen patroon voor de relatie tussen structuur en metabolisme kan worden afgeleid.
In de huidige studie, Lepri et al. testte 198 aza-aromatische verbindingen om te zien of ze waren geoxideerd door AOX. Elk van deze had typische aza-aromatische steigers met variaties op elektronenzuigende en elektronendonerende substituenten. Ze hebben deze catalogus van verbindingen verkregen of gemaakt en vervolgens in vitro metabolismeonderzoeken uitgevoerd met behulp van menselijk levercytosol.
DFT-berekeningen werden gebruikt om de effecten van elektronendichtheid voor AOX-activiteit op te helderen. De plaats van metabolisme op de aromatische verbinding kwam overeen met de meest elektropositieve ongesubstitueerde koolstof, zoals verwacht. Aanvullend, berekeningsstudies werden gebruikt om de koppelingsanalyse van de verbindingen in de actieve plaats van AOX uit te voeren.
De auteurs vonden enkele trends voor de plaats van metabolisme; echter, deze trends worden gecompliceerd door verschillende factoren. De pyridine-steiger was de enige die, als steigerklas, was niet gevoelig voor AOX-metabolisme. De andere groepen waren sterk afhankelijk van de elektronendichtheid van bepaalde koolstoffen of, zoals de auteurs vonden met verbindingen zoals quinoxalines en bepaalde bicyclische verbindingen, sterische hindering in de actieve plaats verhinderde het AOX-metabolisme.
Lepri et al. testte ook 73 amideverbindingen om te zien of AOX de amidebinding hydrolyseerde. In het algemeen, als er een elektronenzuigende groep was in de orthopositie op de analine, dan oxideerde AOX het niet. Als er een elektronendonerende groep was, toen deed het dat. De meta- en para-versies van elektronendonerende en elektronenonttrekkende groepen waren niet gevoelig voor AOX-metabolisme.
Blootstellingseffecten waren een belangrijk onderdeel van de vraag of een verbinding door AOX werd gemetaboliseerd. Dit heeft te maken met de oriëntatie van het molecuul naar het MoCo-centrum in de actieve plaats van AOX. Bepaalde omvangrijke groepen resulteerden in geen activiteit waar men op basis van computationele studies verwachtte. Aanvullend, hydrofobiciteit beïnvloedde ook hoe de verbinding interageerde met de actieve plaats. Wanneer de reactieve koolstof wordt blootgesteld aan het MoCo-centrum, dan wordt de verbinding gemakkelijk gemetaboliseerd. Maar, wanneer het niet-reactieve deel van de verbinding is gericht op het MoCo-centrum, dan is de kans kleiner dat de verbinding wordt geoxideerd of gehydrolyseerd.
De auteurs wijzen erop dat uit deze experimenten "blijkt dat het helemaal niet eenvoudig is om te voorspellen of een verbinding een substraat is van AOX of niet." De moeilijkheid ligt in het begrijpen van de reactiviteit van de elektrofiele koolstof op de verbinding en hoe die specifieke verbinding zich zal oriënteren in de actieve plaats van het enzym. Echter, deze studie biedt een startpunt voor aanvullende studies en meer geavanceerde modelleringstechnieken.
© 2017 Fys.org
Hoofdlijnen
- Hoe een 3D-dwarsdoorsnedemodel van de huid te maken
- Combineer technologie en eeuwenoude tracking om de cheeta te redden
- Nieuwe studie laat zien hoe mierenkolonies zich anders gedragen in verschillende omgevingen
- Nieuwe procedure voor snellere detectie van milieueffecten van zalmkwekerijen
- Convergente evolutie van mimetische vlinders verwart classificatie
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Kunnen mensen eeuwig leven?
- Wat zijn emoties,
- Sequentiebepaling van het genoom van stevia-planten voor het eerst onthuld
- Proton vaste oxide elektrolytische cel vergemakkelijkt niet-geoxideerde dehydrogenering van ethaan

- Computerkatalysatoren - team ontsluit de moleculaire geheimen van een populair polymeer
- Flow chemie techniek biedt snellere, veiligere manier om te screenen, bestuderen en optimaliseren van industriële chemische reacties

- DNA-origami vol krachtige antikankermiddelen
- trekken, niet duwen, zijde kan een revolutie teweegbrengen in de manier waarop groenere materialen worden vervaardigd

 Ja,
Ja,  Energiebesparende LED's stimuleren wereldwijd lichtvervuiling
Energiebesparende LED's stimuleren wereldwijd lichtvervuiling Een manier om glasvezelkabels onder water te gebruiken als seismische sensoren
Een manier om glasvezelkabels onder water te gebruiken als seismische sensoren Hoe de Google Science Fair
Hoe de Google Science Fair Gebruik van witte azijn en isopropylalcohol
Gebruik van witte azijn en isopropylalcohol  Palmolie in de amazone:bedreiging of kans?
Palmolie in de amazone:bedreiging of kans? Thermodynamica van berekeningen:een zoektocht naar de kosten van het runnen van een Turing-machine
Thermodynamica van berekeningen:een zoektocht naar de kosten van het runnen van een Turing-machine Microreactor voor synthese met Grignard-reagentia
Microreactor voor synthese met Grignard-reagentia
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


