
Wetenschap
Virushydrofobiciteit kan helpen bij het zuiveren van vaccins
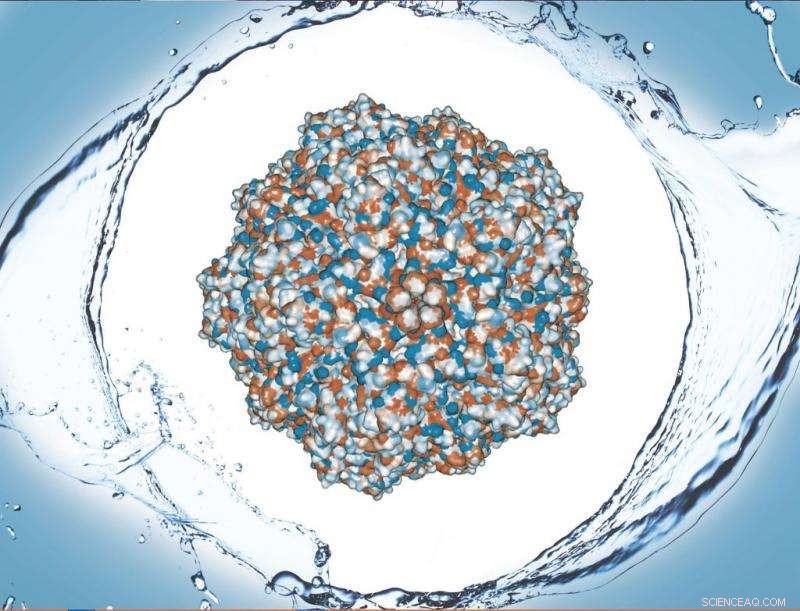
De waterafstotende schil van eiwitten die de capside van een varkensparovirus vormen, stond centraal in het onderzoek van Caryn Heldt. Krediet:Michigan Technological University
Een mens hoeft niet ziek te worden om een virus op te lopen. Onderzoekers hopen virussen te vangen voor detectie en vaccinaties door hun kleverige buitenste lagen te begrijpen.
De complexe structuren die het oppervlak van een virus vormen, zijn kleine weefsels van eiwitten die een grote impact hebben op de interactie van een virus met cellen en zijn omgeving. Een kleine verandering in eiwitvolgorde maakt dit oppervlak enigszins waterafstotend, of hydrofoob, waardoor het aan andere hydrofobe oppervlakken blijft kleven.
Een nieuw papier, onlangs gepubliceerd in Colloïden en oppervlakken B:Bio-interfaces , details oppervlaktehydrofobiciteit in varkensparovirus (PPV).
Vaccins, Verwijdering en detectie
Caryn Heldt, een universitair hoofddocent chemische technologie aan de Michigan Technological University, is de hoofdauteur van de krant. Momenteel, ze is op sabbatical in St. Louis en werkt samen met Pfizer om beter te begrijpen hoe hydrofobiciteit aan het oppervlak kan worden gebruikt om de vaccinatieproductie te verbeteren.
"Vaccinzuivering heeft alles te maken met oppervlakte-interacties; als de componenten uit elkaar vallen, dan kunnen ze niet als therapeutisch worden gebruikt, "Held zegt, eraan toevoegend dat het detecteren en verwijderen van virussen ook afhankelijk is van oppervlakte-interacties. "Dit kan biologen ook helpen de interacties van een virus met een cel te begrijpen."

Chemisch ingenieur Caryn Heldt werkt samen met afgestudeerde student Ashish Saksule in haar lab. Krediet:Michigan Technological University
De belangrijkste bevinding in dit artikel is dat Heldt en haar team experimentele methoden vergeleken met computationele methoden om de oppervlaktechemie te meten.
Modellen en experimenten
Omdat de hydrofobiciteit van virussen relatief nieuw en moeilijk te meten is, Het team van Heldt concentreerde zich op het gebruik van hydrofobiciteitsmodellen als vergelijking. Ze vergeleken de verwachte hydrofobiciteitsmetingen op basis van het belangrijkste eiwit uit het virus, de niet-omhulde PPV, tot goed bestudeerde modeleiwitten die een reeks van afstotend of aantrekkend water omvatten. Vervolgens analyseerden ze de monsters met behulp van twee soorten chromatografie - de analyse van chemische mengsels - samen met fluorescerende kleurstoffen die kleverige, hydrofobe plekken op de eiwitten.
De sleutel is dat de metingen gericht zijn op wat gemakkelijk te bereiken is. Deze locaties maken deel uit van wat het voor oplosmiddelen toegankelijke oppervlak van een kristalstructuur wordt genoemd. Door het waargenomen gebied in een experiment te verkleinen, kon het team de hydrofobiciteit meten.
"De hele viruscapside is een te groot complex om deze berekeningen te doen, "Held zegt, uitleggen dat de capside een buitenste schil is die is gemaakt van 60 kopieën van vergelijkbare eiwitten - VP1, VP2, VP3 - en haar team hebben de blootgestelde delen van VP2 getest welke het meest voorkomt. "Het was interessant dat we nog steeds in staat waren om onze berekeningen voor het blootgestelde oppervlak aan oplosmiddelen te correleren met de experimentele resultaten, omdat we alleen dit ene eiwit gebruikten."
De sterke correlatie tussen de computationele en experimentele resultaten geeft aan dat PPV - en waarschijnlijk andere virussen - een meetbare hydrofobiciteit hebben. Zodra de metingen beter worden begrepen, dan kunnen Heldt en andere onderzoekers virussen beter opvangen. Hierdoor kan het detecteren van virussen, ze te concentreren en vaccins te zuiveren.
 Twee bacteriële co-culturen verbeteren de microbe-co-afbraak van dicarboximide-fungiciden
Twee bacteriële co-culturen verbeteren de microbe-co-afbraak van dicarboximide-fungiciden Hydrogeneringsregeling van nitrobenzeen in elektrokatalytische processen gerealiseerd
Hydrogeneringsregeling van nitrobenzeen in elektrokatalytische processen gerealiseerd Germanium belooft betere opto-elektronische eigenschappen dan tin voor kesterite-zonnecellen
Germanium belooft betere opto-elektronische eigenschappen dan tin voor kesterite-zonnecellen Wat is butaanbrandstof?
Wat is butaanbrandstof?  Wetenschappers stellen nieuwe bifunctionele katalysatoren voor op van biomassa afgeleide koolstof
Wetenschappers stellen nieuwe bifunctionele katalysatoren voor op van biomassa afgeleide koolstof
 Wetenschappers racen om het kusterfgoed van Puerto Rico te documenteren
Wetenschappers racen om het kusterfgoed van Puerto Rico te documenteren 3D-modellen van bergmeren met een draagbare sonar en laser in de lucht
3D-modellen van bergmeren met een draagbare sonar en laser in de lucht Nieuwe biomassakaart om de koolstof van de wereld te inventariseren
Nieuwe biomassakaart om de koolstof van de wereld te inventariseren Is het haalbaar om koolstofdioxide uit de atmosfeer te verwijderen?
Is het haalbaar om koolstofdioxide uit de atmosfeer te verwijderen? Klimaatverandering verandert de samenstelling van riffen
Klimaatverandering verandert de samenstelling van riffen
Hoofdlijnen
- Otzi the Iceman at een vetrijke laatste maaltijd
- De verschillen tussen mannelijke pollen en vrouwelijke zaden dennenappels
- Codominantie: definitie, toelichting en voorbeeld
- Insecten kunnen mensen leren omgaan met tegenslag
- De eigenschappen van steenzout
- Een enzym dat de vorming van het DNA katalyseert Molecuul
- Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit
- Deze ringstaartmaki's veroorzaken een stank als ze flirten met potentiële partners
- Wat gebeurt er als je een lijk ontdooit?
- Hoe de concentratie te vinden wanneer u de pH krijgt

- Chemicus maakt goedkope katalysatoren voor de productie van vanilline
- Zilverzout dat wordt gebruikt om C-C-bindingen in ongespannen cyclische aminen te verbreken
- De metaalindustrie staat op het punt een van de grootste omwentelingen in de geschiedenis te ondergaan, deskundige zegt:

- Onderzoekers rapporteren nieuwe oxyfluorideverbinding voor fotokatalyse
 Onderzoekers ontwikkelen module voor kwantumrepeater
Onderzoekers ontwikkelen module voor kwantumrepeater Een recht op water
Een recht op water Nieuwe methode lost oud mysterie op:Hafnium-isotopen bepalen de oorsprong van hoogwaardig Romeins glas
Nieuwe methode lost oud mysterie op:Hafnium-isotopen bepalen de oorsprong van hoogwaardig Romeins glas Standaardmodel van het universum doorstaat de meest nauwkeurige test van Dark Energy Survey (update)
Standaardmodel van het universum doorstaat de meest nauwkeurige test van Dark Energy Survey (update) Tweederde van de Himalaya-gletsjers zou kunnen smelten, studie waarschuwt
Tweederde van de Himalaya-gletsjers zou kunnen smelten, studie waarschuwt Röntgendiffractie onthult details in mummies zonder ze te hoeven openen
Röntgendiffractie onthult details in mummies zonder ze te hoeven openen ESO's Cosmic Gems-programma legt de stoffige wolken van de Cosmic Bats vast
ESO's Cosmic Gems-programma legt de stoffige wolken van de Cosmic Bats vast Kunnen we energie van tornado's en orkanen benutten?
Kunnen we energie van tornado's en orkanen benutten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

