
Wetenschap
Hoe beschrijf je een Daniell -cel?
componenten:
* twee halve cellen:
* anode: Samengesteld uit een zinkelektrode ondergedompeld in een zinksulfaatoplossing (ZnSO₄). Zink wordt geoxideerd bij de anode en brengt elektronen in het externe circuit vrij.
* kathode: Samengesteld uit een koperelektrode ondergedompeld in een kopersulfaatoplossing (CUSO₄). Koperionen (Cu²⁺) in de oplossing worden verminderd bij de kathode, waardoor elektronen van het externe circuit worden geaccepteerd.
* Salt Bridge: Een poreuze barrière die de twee halve cellen verbindt. Hiermee kan de stroom van ionen elektrische neutraliteit in de oplossingen handhaven, waardoor de opbouw van lading wordt voorkomen die de reactie zou stoppen.
* extern circuit: Een draad die de anode en de kathode verbindt, waardoor elektronen van de anode naar de kathode kunnen stromen.
reactie:
De algemene reactie in een Daniell -cel is:
Zn (s) + cu²⁺ (aq) → Zn²⁺ (aq) + cu (s)
* anode (oxidatie): Zn (s) → Zn²⁺ (aq) + 2e⁻
* kathode (reductie): Cu²⁺ (aq) + 2e⁻ → cu (s)
Hoe het werkt:
1. zinkatomen aan de anode verliezen elektronen en worden zinkionen (Zn²⁺), die oplossen in de zinksulfaatoplossing.
2. elektronen stromen door het externe circuit Van de anode naar de kathode.
3. Koperionen (Cu²⁺) in de kopersulfaatoplossing accepteren elektronen bij de kathode en worden gereduceerd tot koperatomen, afzetting op de koperelektrode.
4. Met de zoutbrug kan ionen tussen de halve cellen stromen om elektrische neutraliteit te behouden. Dit voorkomt de opbouw van positieve lading in de zinkhalfcel en negatieve lading in de koperen halve cel.
Kenmerken:
* produceert een gestage spanning van ongeveer 1,1 volt.
* heeft een relatief lange levensduur.
* niet-oplaadbaar. Zodra de zinkelektrode is verbruikt, werkt de cel niet meer.
Toepassingen:
* Historisch gezien werden Daniell -cellen gebruikt als een praktische bron van elektriciteit.
* Vandaag worden ze voornamelijk gebruikt in educatieve instellingen om de principes van elektrochemie aan te tonen.
Samenvattend:
De Daniell -cel is een eenvoudig maar belangrijk voorbeeld van een elektrochemische cel die chemische energie omzet in elektrische energie. Het toont de principes van oxidatie-reductiereacties, elektronenstroom en ionisch transport, en biedt een fundamenteel begrip van hoe batterijen werken.
 Is suiker meer oplosbaar dan kopersulfaat?
Is suiker meer oplosbaar dan kopersulfaat?  Wat zijn vijf voorbeelden van chemische verwering?
Wat zijn vijf voorbeelden van chemische verwering?  Is methaan een ionische of covalente binding?
Is methaan een ionische of covalente binding?  Onderzoekers ontwikkelen sensoren die menselijke biomarkers en giftig gas detecteren
Onderzoekers ontwikkelen sensoren die menselijke biomarkers en giftig gas detecteren Welke organel wijzigt en pakketten voor het afscheiding van de materialen die door ribosomen worden geproduceerd?
Welke organel wijzigt en pakketten voor het afscheiding van de materialen die door ribosomen worden geproduceerd?
 Hoe koolstofverwijdering past in de architectuur van het EU-klimaatbeleid
Hoe koolstofverwijdering past in de architectuur van het EU-klimaatbeleid  Houd de mosterd vast:wat maakt spinnen kieskeurige eters?
Houd de mosterd vast:wat maakt spinnen kieskeurige eters?  Vloeipunten:een nieuwe methode voor het beheer van watervoorraden in bossen
Vloeipunten:een nieuwe methode voor het beheer van watervoorraden in bossen  Wetenschappers verklaren de effecten van stralingsforcering door aerosolen
Wetenschappers verklaren de effecten van stralingsforcering door aerosolen Sterke en diepe onderzeese aardbeving schudt Oost-Indonesië
Sterke en diepe onderzeese aardbeving schudt Oost-Indonesië
Hoofdlijnen
- Bijtkrachtonderzoek onthult dinosaurus-etende kikker
- Moet het houden van reptielen en amfibieën als huisdier worden beperkt?
- Hoe had de regering invloed op de kiemtheorie?
- Wat is de decoder van mRNA?
- Wat zijn twee organismen van verschillende soorten die samen leven en beide profiteren van woonarrangementen?
- Waarom is de evolutie van bacteriën snel?
- Wormen leren hoe ze het foerageren kunnen optimaliseren door de sociale signalen van hun reactie te veranderen
- Tot welke macromolecuulgroep behoren enzymen?
- Waarmee worden wetenschappelijke hypothesen het vaakst getest?
- Hoe lepra werkt

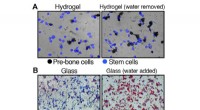
- Hoeveelheid water in stamcellen kan zijn lot bepalen als vet of bot
- Decodering van hondencognitie:machine learning geeft een glimp van hoe het brein van een hond vertegenwoordigt wat het ziet

- Afrikaanse slaapziekte:hoe de ziekteverwekker tseetseevliegen koloniseert
- Het leefgebied van de panda krimpt, steeds meer gefragmenteerd worden

 Oude genomica lokaliseert de oorsprong en snelle omzet van vee in de Vruchtbare Halve Maan
Oude genomica lokaliseert de oorsprong en snelle omzet van vee in de Vruchtbare Halve Maan Studie wijst op nieuw wapen in strijd tegen dodelijke schimmels
Studie wijst op nieuw wapen in strijd tegen dodelijke schimmels Welk evenement hielp bij het bewijzen van Einsteins voorspelling dat licht buigt in de buurt van de zon?
Welk evenement hielp bij het bewijzen van Einsteins voorspelling dat licht buigt in de buurt van de zon?  Een krachtig lasersysteem voor het aansturen van geavanceerde experimenten in de attoseconde wetenschap
Een krachtig lasersysteem voor het aansturen van geavanceerde experimenten in de attoseconde wetenschap NASA's Terra Satellite ziet een vonk van leven in de overblijfselen van de voormalige tropische depressie 01Ws
NASA's Terra Satellite ziet een vonk van leven in de overblijfselen van de voormalige tropische depressie 01Ws Wat is de cohesiewaarde van zand?
Wat is de cohesiewaarde van zand?  Rechts- of linkshandig? Genexpressie vertelt het verhaal van de evolutie van de slak
Rechts- of linkshandig? Genexpressie vertelt het verhaal van de evolutie van de slak  Wat noemden de oude Egyptenaren Orion?
Wat noemden de oude Egyptenaren Orion?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

