
Wetenschap
Afrikaanse slaapziekte:hoe de ziekteverwekker tseetseevliegen koloniseert
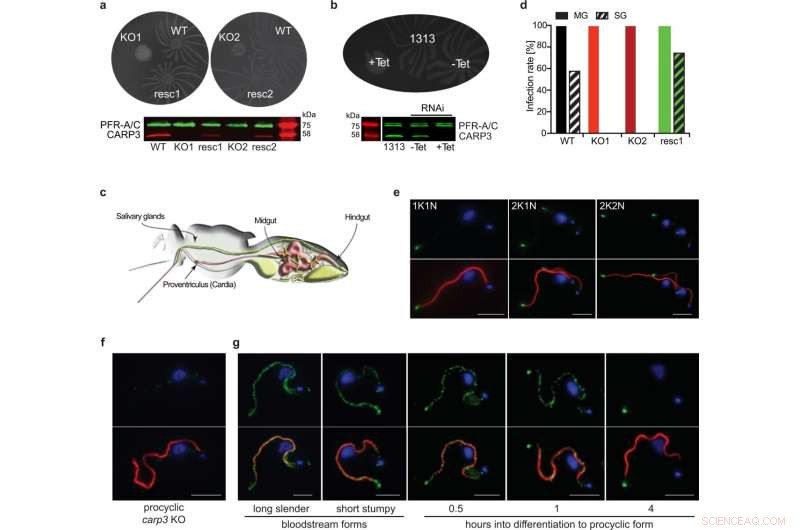
CARP3 is een flagellaire tipregulator van sociale motiliteit (SoMo) en is essentieel voor de kolonisatie van de speekselklieren van de tseetseevlieg. a SoMo-assays van procyclische T. brucei AnTat 1.1 wildtype (WT), carp3 knock-out (KO, onafhankelijke klonen KO1, KO2) of in situ CARP3-rescue (resc, onafhankelijke klonen resc1, resc2). De Western-blot werd onderzocht met anti-CARP3 en anti-PFR-A/C (laadcontrole). b SoMo-assay op tetracycline (Tet)-induceerbare RNAi van CARP3 (-Tet / +Tet 24 h) en de ouderlijke AnTat 1.1 1313-cellijn. De Western-blot toont CARP3-repressie gedetecteerd door antilichamen zoals in (a). c Illustratie van het spijsverteringsstelsel en de speekselklieren van een tseetseevlieg (overgenomen van 91). d Infectiepercentages van tseetseevlieg-middendarm (MG) of speekselklieren (SG) met T. brucei AnTat 1.1-cellijnen zoals in (a). Vliegen werden 34-36 dagen p.i. ontleed, n (vliegen) =48 (WT), 50 (KO1), 50 (KO2), 40 (resc1). 10 mM L-glutathion werd opgenomen in de bloedmaaltijd (Instituut voor Tropische Geneeskunde Antwerpse tseetseevliegenkolonie). Indirecte immunofluorescentieanalyse van CARP3 (groen) in T. brucei AnTat 1.1 procyclische vorm WT (e) of carp3 KO (f). De bovenste panelen tonen CARP3 (groen) en het nucleaire en mitochondriale DNA gekleurd met DAPI (blauw), de onderste panelen tonen een overlay met het axoneme (rood; gekleurd met het antilichaam mAB25). In (e) worden cellen in verschillende stadia van de celcyclus getoond (1K1N, 2K1N, 2K2N; K-kinetoplast, N-kern). g Indirecte immunofluorescentie-analyse van CARP3 (groen) zoals in (e, f) tijdens cultuurdifferentiatie van bloedbaan naar procyclische vormen. Schaalbalk in (e–g) 5 m. Brongegevens bij (a, b) en (d) worden geleverd als brongegevensbestand. Krediet:Natuurcommunicatie (2022). DOI:10.1038/s41467-022-33108-z
LMU-onderzoekers hebben een cruciaal signaleringsmechanisme ontcijferd waarmee trypanosomen de speekselklieren van de vliegen kunnen bereiken.
Tseetseevliegen komen veel voor in een groot deel van Afrika. Ze voeden zich met het bloed van mensen en andere dieren. Daarbij kunnen ze trypanosomen, een protozoaire parasiet, overbrengen. Trypanosoma brucei veroorzaakt slaapziekte bij mensen. Ziekteverwekkers infiltreren de gastheer via het speeksel van geïnfecteerde tseetseevliegen:vanuit het bloed bereiken ze de hersenen, met dodelijke symptomen als ze niet worden behandeld.
Maar hoe komen trypanosomen na hun bloedmaaltijd in de speekselklieren van tseetseevliegen? Dr. Sabine Bachmaier en professor Michael Boshart van de afdeling Genetica van de faculteit Biologie van de LMU hebben samen met wetenschappelijke collega's een verrassend antwoord op deze vraag gevonden.
Ze laten zien dat een signaleringsapparaat aan de flagellaire punt van de protozoa de migratie van trypanosomen in de tseetseevlieg regelt via de boodschapper die bekend staat als cyclisch adenosinemonofosfaat (cAMP). De verwijdering van een component van het enzymcomplex dat het cAMP-signaleringsmolecuul produceert, was voldoende om infectie van de vliegen te voorkomen. De resultaten van het onderzoek zijn nu gepubliceerd in Nature Communications .
Inzichten in het regelgevende netwerk
Ter achtergrond:Runderen en antilopen zijn natuurlijke reservoirs van Trypanosoma brucei. Tijdens een bloedmaaltijd komen ziekteverwekkers in het maagdarmkanaal van tseetseevliegen. Om te overleven en zich verder te verspreiden, moeten trypanosomen zich aanpassen aan hun veranderende omgeving. Ze migreren heen en weer tussen de bloedbaan en de weefsels van een zoogdiergastheer en tussen het spijsverteringskanaal en de speekselklieren van een tseetseevlieg, waarbij ze een reeks ontwikkelingsstadia doorlopen.
"Ons project is gebaseerd op verschillende internationale samenwerkingen met onderzoeksgroepen in Parijs, Antwerpen en Rio de Janeiro", zegt Bachmaier. "We waren al lang geïnteresseerd in de vraag hoe parasieten erin slagen zich te oriënteren in de tseetseevlieg - en hoe dit kan worden voorkomen om de overdracht van de ziekte te beheersen."
Ongeveer tien jaar geleden identificeerde de onderzoeksgroep een nieuwe en trypanosoom-specifieke component van de cAMP-signaleringsroute:het cyclische AMP-responseiwit 3 (CARP3). "Onze ontdekking dat CARP3 voornamelijk wordt gevonden aan het uiteinde van de flagella van trypanosomen, bracht ons op de geur van een gespecialiseerd signaalapparaat voor de oriëntatie van de parasieten in de tseetseevlieg", zegt Bachmaier.
Toen de onderzoekers het CARP3-gen door middel van genetische manipulatie verwijderden, veranderde ook de samenstelling van de enzymen (adenylaatcyclasen) die cAMP produceren aan de flagellaire punt. "Trypanosomen waren vervolgens niet meer in staat om tseetseevliegen efficiënt te koloniseren", legt de wetenschapper uit. "In de speekselklieren vonden we geen enkele cel van de parasieten meer."
Van fundamenteel onderzoek tot toepassing:Het doel van een langetermijnstrategie zou kunnen zijn om de interacties tussen CARP3 en adenylaatcyclasen te verminderen. Dit zou bijvoorbeeld kunnen door middel van een synthetisch peptide dat in de vliegen zou worden geproduceerd met behulp van de techniek die bekend staat als paratransgenese. Zonder de speekselklieren van tseetseevliegen te koloniseren, zouden de trypanosomen niet langer worden overgedragen. + Verder verkennen
Hoe Nagana wordt gedragen door tseetseevliegen
 Dun, rekbare biosensoren kunnen chirurgie veiliger maken
Dun, rekbare biosensoren kunnen chirurgie veiliger maken Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen
Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen Hoe Biogas
Hoe Biogas Maretakbessen kunnen het geheim bevatten voor het maken van biologische superlijm
Maretakbessen kunnen het geheim bevatten voor het maken van biologische superlijm Wetenschappers gebruiken coöperatieve actie van een ligand-tegenionsysteem voor duurzame etherproductie
Wetenschappers gebruiken coöperatieve actie van een ligand-tegenionsysteem voor duurzame etherproductie
 Mineralen in vulkanisch gesteente bieden nieuwe inzichten in de eerste 1,5 miljard jaar van de evolutie van de aarde
Mineralen in vulkanisch gesteente bieden nieuwe inzichten in de eerste 1,5 miljard jaar van de evolutie van de aarde Een nieuw model gevonden om de voortplantingssnelheid van aardbevingen te voorspellen
Een nieuw model gevonden om de voortplantingssnelheid van aardbevingen te voorspellen Het Zwarte Woud en klimaatverandering
Het Zwarte Woud en klimaatverandering VN-rapport over mission impossible klimaatdoel:kernpunten
VN-rapport over mission impossible klimaatdoel:kernpunten Met aandacht voor virus, Ontbossing Amazonië neemt toe
Met aandacht voor virus, Ontbossing Amazonië neemt toe
Hoofdlijnen
- Het unieke pentraxine-koolzuuranhydrase-eiwit reguleert het vermogen van vissen om te zwemmen
- Vier belangrijke typen chromosomen
- Celstructuren en hun drie belangrijkste functies
- Disruptieve bio-engineering - verandert de manier waarop cellen met elkaar omgaan
- Fossiele visvangst uit China bevat oudste tanden ooit
- Wat doet ons gapen?
- De individuele handtekeningen onderzoeken van de kreten die hyena's maken
- Video-enquêtes laten zien dat soorten zeeslangen zich in de diepte verbergen bij Ashmore Reef
- Greenpeace laat rotsblokken op de Britse zeebodem vallen om de bodemtrawlvisserij te beteugelen
- Hebben alle mensen een uniek genotype en fenotype?
- Geheugenhack:doe wat aerobics vier uur na de les

- Hoe celconcentratie te berekenen

- Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierencel?

- Geluidsoverlast veroorzaakt chronische stress bij vogels, met gezondheidsgevolgen voor jongeren

 Tweedimensionale nanosheets maken hoogwaardige controle over de oriëntatie van dunne films mogelijk
Tweedimensionale nanosheets maken hoogwaardige controle over de oriëntatie van dunne films mogelijk Zelf-geassembleerde microbolletjes van silica om oppervlakken te koelen zonder energieverbruik
Zelf-geassembleerde microbolletjes van silica om oppervlakken te koelen zonder energieverbruik Het klimaatlevensverhaal van de aarde, 3 miljard jaar in de maak
Het klimaatlevensverhaal van de aarde, 3 miljard jaar in de maak Een betere manier om DNA-steigers te bouwen
Een betere manier om DNA-steigers te bouwen Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van de enzymactiviteit?
Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van de enzymactiviteit?  Fossiele tandanalyse brengt de vroegste mensen uit zuidelijk Afrika aan het licht
Fossiele tandanalyse brengt de vroegste mensen uit zuidelijk Afrika aan het licht Onderzoekers ontdekken ongebruikelijk celdodend mechanisme voor moleculen
Onderzoekers ontdekken ongebruikelijk celdodend mechanisme voor moleculen Nanodeeltjes presenteren duurzame manier om voedselgewassen te verbouwen
Nanodeeltjes presenteren duurzame manier om voedselgewassen te verbouwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

