
Wetenschap
Nieuwe structuren bieden inzicht in hoe een bacteriële motor bacteriële chemotaxis aandrijft, een belangrijk infectieus proces
Bacteriën bestonden al millennia vóór de mens en infecteerden ons vanaf het begin. Hoewel we infecties kunnen behandelen met medicijnen, blijven bacteriën resistent worden tegen behandeling dankzij hun snelle evolutie. Bacteriële infecties blijven een belangrijke oorzaak van morbiditeit en mortaliteit in 2024, resulterend in bijna acht miljoen jaarlijkse sterfgevallen wereldwijd.
Eén belangrijk kenmerk dat alle infectieuze bacteriën gemeen hebben, is chemotaxis. Chemotaxis is een veelzijdig proces waarmee bacteriën naar energierijke moleculen kunnen zwemmen, favoriete niches voor infectie kunnen vinden, schadelijke soorten kunnen vermijden, de snelheid kunnen veranderen en volledig kunnen stoppen met het vormen van biofilms. Chemotaxis is ook essentieel voor de virulentie bij dieren en een potentieel doelwit voor nieuwe therapieën. Maar eerst moet het proces zelf beter worden begrepen.
Het laboratorium van Tina Iverson, Louise B. McGavock Professor en hoogleraar farmacologie, in samenwerking met onderzoekers van de Universiteit van Californië, San Francisco; Stanford universiteit; en het Weizmann Institute of Science in Israël hebben nieuw werk gepubliceerd in Nature Microbiology , wat nieuwe inzichten oplevert over chemotaxis.
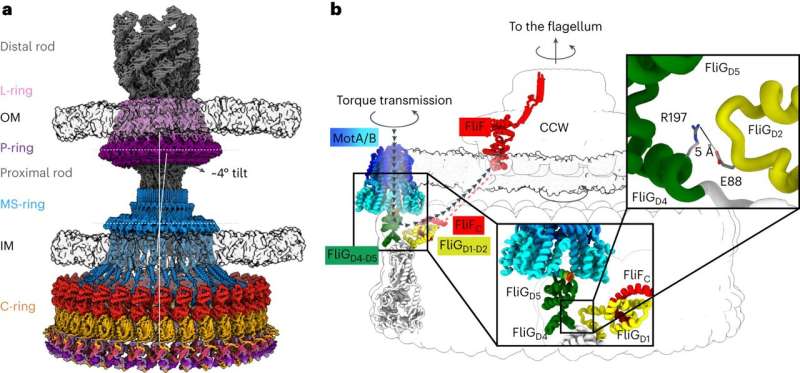
Voor chemotaxis is een kleine motor nodig die een flagellum laat draaien – een haarachtig aanhangsel van bacteriën dat ronddraait om voor voortstuwing te zorgen, zoals een bootmotor. Door het flagellum met verschillende snelheden met de klok mee of tegen de klok in te draaien, kunnen bacteriën zich naar verschillende stimuli toe of ervan af bewegen. Huidig onderzoek heeft geen overeenstemming opgeleverd over de architectuur van de centrale componenten van de motor die het flagellum aandrijft, wat het inzicht van onderzoekers in en het vermogen om chemotaxis met medicijnen aan te pakken, heeft belemmerd.
Het huidige werk, onder leiding van senior onderzoeksmedewerker in het Iverson-laboratorium Prashant Singh, brengt nieuwe informatie naar voren over hoe een motorcomponent, een zogenaamde schakelaar, de rotatie omkeert en koppel overbrengt naar het flagellum.
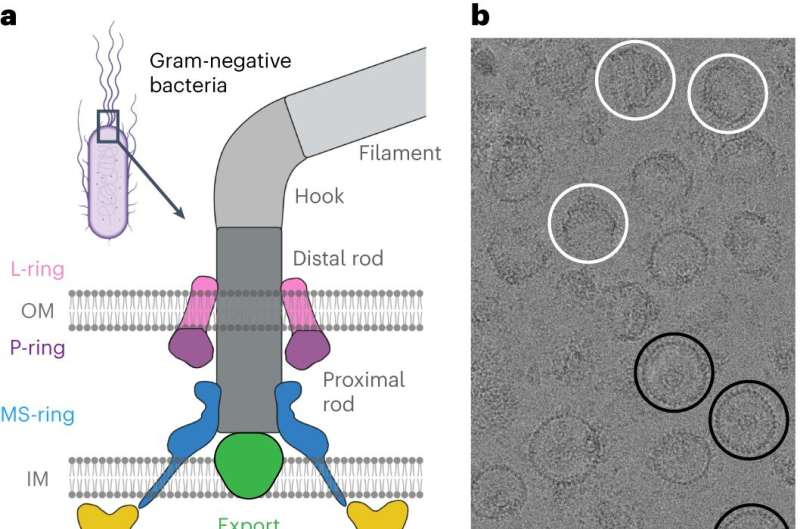
Om dit te doen, keken de onderzoekers naar Salmonella enterica, een bacterie die wereldwijd verantwoordelijk is voor ongeveer 60.000 sterfgevallen per jaar, als model. Na het isoleren en zuiveren van S. enterica-motoren die in verschillende zwemconfiguraties waren gestabiliseerd, maakten de medewerkers gebruik van de kracht van Vanderbilt's Titan Krios, een cryo-elektronenmicroscoop van $ 10 miljoen, aangeschaft door de School of Medicine Basic Sciences en beschikbaar gesteld via de Cryo van het Center for Structural Biology. -EM-faciliteit.
De structuren gaven de onderzoekers informatie over hoe de bacteriële motor de rotatie van het flagellum met de klok mee en tegen de klok in aandrijft, waardoor een bacterie recht kan zwemmen of van richting kan veranderen tijdens het zwemmen. Het hielp hen ook te begrijpen hoe eiwitten zich aan de motor binden om de bacteriële beweging te helpen reguleren.
Deze resultaten zijn van toepassing op een breed scala aan infecties. De Salmonella chemotaxis-machinerie is bijvoorbeeld vrijwel identiek aan die van Escherichia coli, die alleen al in de VS verantwoordelijk is voor meer dan 250.000 infecties per jaar. Omdat chemotaxis nodig is voor infectie, kan het selectief verstoren van de interacties waardoor ziekteverwekkers een reservoir binnen een organisme kunnen vormen, terugkerende infecties helpen voorkomen zonder het normale microbioom te beïnvloeden.
Het Iverson-lab werkt nu aan het identificeren van de manier waarop een groter aantal verschillende eiwitpartners zich binden aan de flagellaire motor tijdens chemotaxis, en hoopt dat dit zal leiden tot manieren om chemotaxis tijdens infectie te verstoren.