
Wetenschap
Wetenschappers onthullen hoe belangrijk kankerdoelwit de verspreiding van kanker kan stoppen
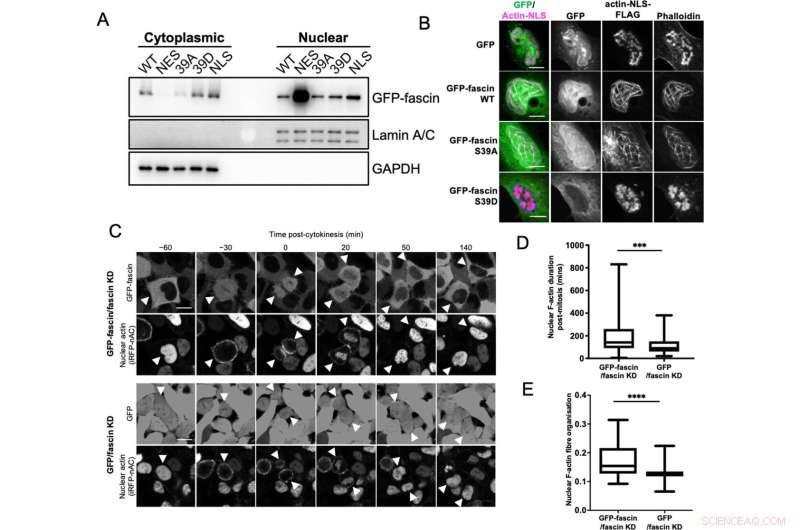
Nucleaire fascine draagt bij aan bundeling van F-actine. (A) Representatieve western blot van fascin knockdown (KD) HeLa-cellen die gespecificeerde GFP-fascin-constructen tot expressie brengen die zijn onderworpen aan biochemische fractionering. Nucleaire en cytoplasmatische compartimenten onderzocht op GFP-fascin (80 kDa), Lamin A/C (69/62 kda) en GAPDH (36 kDa). Vertegenwoordiger van drie onafhankelijke experimenten. (B) Representatieve confocale beelden van kernen van fascine KD HeLa-cellen die gespecificeerde GFP-fascin-constructen (groen) en actine-NLS-FLAG-construct tot co-expressie brengen, gefixeerd en gekleurd voor FLAG (magenta) en F-actine (phalloidin). Schaalbalken zijn 10 µm. (C) Representatieve foto's van time-lapse confocale films van fascinerende KD HeLa-cellen die GFP of GFP-fascin (bovenste panelen) en iRFP-nAC nucleaire F-actine-sonde (onderste panelen) voor en na cytokinese tot expressie brengen. Pijlpunten wijzen naar delende of dochtercellen. Schaalbalken zijn 10 µm. (D) Kwantificering van de duur van nucleaire F-actine-filamenten in cellen zoals in (C). (E) Organisatie van nucleaire F-actine in gesynchroniseerde cellen, 10 uur na vrijlating. Voor (D) en (E), N =89-100 cellen / conditie, samengevoegd uit drie onafhankelijke experimenten. Grafieken tonen min/max en gemiddelde van dataset. ***=p <0,001, ****=p <0,0001. Tegoed:eLife (2022). DOI:10.7554/eLife.79283
Onderzoekers hebben aangetoond dat een eiwit dat fascin wordt genoemd in het controlecentrum van kankercellen werkt en hun vermogen om zichzelf te herstellen, te groeien en te bewegen beïnvloedt, volgens een onderzoek dat vandaag in eLife is gepubliceerd. .
De studie onthult een belangrijke route waarlangs fascine de ontwikkeling van kanker bevordert en geeft inzicht in mogelijke paden die de werking ervan kunnen blokkeren.
Van Fascin is bekend dat het de structuren controleert die cellen in staat stellen te bewegen - met name de assemblage van bundels van een eiwit genaamd actine, die de kleine "pootjes" creëren die kankercellen gebruiken om naar verre plaatsen in het lichaam te migreren. Het is ook bekend dat fascin zich op veel hogere niveaus bevindt in de meeste solide tumoren, waar het kankercellen helpt migreren en binnendringen in andere weefsels. Deze invasie - of "metastase" - van tumorcellen is de belangrijkste reden waarom veel kankers zo moeilijk te behandelen zijn
"We hebben eerder aangetoond dat fascinatie zich op bepaalde momenten in de groeicyclus van de cel in het controlecentrum van de cel - de kern - bevindt", legt hoofdauteur Campbell Lawson, onderzoeksmedewerker bij het Randall Center for Cell and Molecular Biophysics, King's College London uit. , VK "Het was echter niet bekend hoe de beweging of functie van de fascine in de kern wordt gecontroleerd, en dit belemmert ons vermogen om behandelingen te ontwikkelen die de rol ervan bij het bevorderen van de groei en verspreiding van kanker blokkeren."
Om fascine verder te begrijpen, creëerde het team een reeks kankercellijnen met en zonder functionele fascine, evenals een reeks fascinische "nanobodies" gelabeld met fluorescerende markers, om de locatie in cellen te veranderen en de interacties met andere eiwitten in de cel te onderzoeken. kern.
Ze ontdekten dat fascine actief in en uit de kern wordt getransporteerd en, eenmaal daar, de assemblage van actinebundels ondersteunt. Inderdaad, cellen zonder fascine waren niet in staat om in dezelfde mate nucleaire actinebundels op te bouwen. Fascin interageerde ook met een andere groep belangrijke eiwitten in de celkern, histonen genaamd. Wanneer fascine niet betrokken is bij het bundelen van actine, is het gebonden aan histon H3 - een belangrijke speler die betrokken is bij het organiseren van DNA in de kern.
Gezien de interactie van fascin met histonen, heeft het team gekeken of fascin ook betrokken was bij DNA-herstelprocessen in kankercellen, wat hen helpt te overleven. Ze ontdekten dat het DNA-herstel was aangetast in cellen die geen fascien hadden, wat aangeeft dat het eiwit nodig kan zijn voor kankercellen om hun reactie op DNA-schade veroorzaakt door chemo- of radiotherapie te activeren. Fascine-uitgeputte cellen hadden ook veranderingen in hun chromatinestructuur - de manier waarop het DNA in de cel is verpakt - in vergelijking met cellen met normale fascineniveaus.
Hoewel nucleaire fascine een belangrijke rol speelt bij de assemblage van nucleaire actine, de DNA-structuur en het herstel, is het ook belangrijk in het celcytoplasma, waar het kankercellen helpt bij het bouwen van kleine aanhangsels, filopodia genaamd, die invasie bevorderen. Dus het team wilde begrijpen of het verplaatsen van alle fascie naar de kern de cytoplasmatische functie van fascin zou voorkomen.
Zoals ze verwachtten, was in cellen met een verhoogde nucleaire fascine het aantal filopodia aanzienlijk verminderd omdat er geen fascine in het cytoplasma was om de assemblage van deze structuren te ondersteunen. De cellen drongen ook minder binnen in 3-dimensionale steigers die het weefsel rondom tumoren nabootsen. Belangrijk is dat cellen die nucleaire fascinatie hadden geforceerd, de groeisnelheid en levensvatbaarheid aanzienlijk verminderden omdat ze grote stabiele actinebundels in de kern verzamelden waardoor ze niet door de celcyclus konden gaan. Gezamenlijk geven deze resultaten aan dat, in plaats van te proberen manieren te vinden om fascinatie te blokkeren, het allemaal in de kern van kankercellen wordt gedwongen hun groei en beweging te voorkomen.
"Onze studie biedt inzicht in een nieuwe rol voor fascine bij het beheersen van bundeling van nucleaire actine om de levensvatbaarheid van tumorcellen te ondersteunen", concludeert senior auteur Maddy Parsons, hoogleraar celbiologie aan het Randall Center for Cell and Molecular Biophysics, King's College London. "Aangezien fascine op zeer hoge niveaus aanwezig is in veel solide tumoren, maar niet in normale weefsels, is dit molecuul een interessant therapeutisch doelwit. We stellen voor om de accumulatie van fascine in de kern van kankercellen te bevorderen, in plaats van alleen te focussen op het richten in de cel cytoplasma, zou een alternatieve benadering kunnen zijn die zowel tumorgroei als verspreiding zou voorkomen." + Verder verkennen
Hoe celkernen in krappe ruimtes knijpen
 Bouwmaterialen komen tot leven met hulp van bacteriën
Bouwmaterialen komen tot leven met hulp van bacteriën Wetenschappers identificeren eiwitten die mogelijk bestonden toen het leven begon
Wetenschappers identificeren eiwitten die mogelijk bestonden toen het leven begon Kleine microplastics glippen niet meer door de kieren met nieuwe detectiemethode
Kleine microplastics glippen niet meer door de kieren met nieuwe detectiemethode Wat betekent gehydrogeneerd?
Wat betekent gehydrogeneerd?  Buigbaar beton en andere met koolstof doordrenkte cementmengsels kunnen de wereldwijde uitstoot drastisch verminderen
Buigbaar beton en andere met koolstof doordrenkte cementmengsels kunnen de wereldwijde uitstoot drastisch verminderen
 Neerslag in Centraal-Azië gevormd door de temperatuur van het zeeoppervlak boven de tropische Stille Oceaan en de Noord-Atlantische Oceaan
Neerslag in Centraal-Azië gevormd door de temperatuur van het zeeoppervlak boven de tropische Stille Oceaan en de Noord-Atlantische Oceaan Rook van bosbranden verandert drastisch naarmate het ouder wordt, en dat is belangrijk voor de luchtkwaliteit benedenwinds
Rook van bosbranden verandert drastisch naarmate het ouder wordt, en dat is belangrijk voor de luchtkwaliteit benedenwinds Voorkomen van toename van extreme hitte in Oost-Azië met 0,5 graden C
Voorkomen van toename van extreme hitte in Oost-Azië met 0,5 graden C Onderzoekers onderzoeken hoe Antarctische ijskappen zullen reageren op klimaatverandering en wereldwijde zeespiegelstijging
Onderzoekers onderzoeken hoe Antarctische ijskappen zullen reageren op klimaatverandering en wereldwijde zeespiegelstijging Puimsteen arriveert en levert vitamineboost aan het rif
Puimsteen arriveert en levert vitamineboost aan het rif
Hoofdlijnen
- Wetenschappers ontwikkelen microben om herinneringen aan hun omgeving te vormen
- Wetenschappelijke evaluatie van neushoorndiëten verbetert dierentuin
- De wetenschap ontdekt waarom sommigen van ASMR-video's houden en anderen ze haten
- Nieuwe vogeltrekatlas toont buitengewone reizen
- Stadia van een typische celcyclus
- Zelfs wilde zoogdieren hebben regionale dialecten
- Big data helpt onderzoekers in de strijd om plantenindringers onder controle te krijgen
- Urban Coopers-haviken overtreffen hun landelijke buren
- Stamcellen die vetweefsel genereren, hebben een circadiane klok
- Aan vuur aangepaste insecten maken optimaal gebruik van door bosbranden gesteriliseerde broedplaatsen

- Waarom insecten zich kunnen ontwikkelen uit onbevruchte eicellen

- Moeten we de genen van buitengewone mensen sparen voor klonen?

- Onderzoekers rapporteren een fundamentele spiersnelheidslimiet

- Grootte is belangrijk - hoe trips hun partners kiezen

 Verkopers op websites met rubrieksadvertenties geven de voorkeur aan kopers uit welvarende buurten
Verkopers op websites met rubrieksadvertenties geven de voorkeur aan kopers uit welvarende buurten Nieuw onderzoek ondersteunt de vulkanische oorsprong van ijzererts van het Kiruna-type
Nieuw onderzoek ondersteunt de vulkanische oorsprong van ijzererts van het Kiruna-type Beheersing van antropogene emissies kan de waterkwaliteit in kustzeeën verbeteren
Beheersing van antropogene emissies kan de waterkwaliteit in kustzeeën verbeteren Nieuw sphenisciform fossiel lost verder bauplan van uitgestorven reuzenpinguïns op
Nieuw sphenisciform fossiel lost verder bauplan van uitgestorven reuzenpinguïns op NASA Waterdampgegevens onthullen het doorweekvermogen van de tropische storm Gonzalos
NASA Waterdampgegevens onthullen het doorweekvermogen van de tropische storm Gonzalos Nieuwe kaarttool ter ondersteuning van het zoeken naar hoogwaardige, op de natuur gebaseerde CO2-credits
Nieuwe kaarttool ter ondersteuning van het zoeken naar hoogwaardige, op de natuur gebaseerde CO2-credits Hernieuwbare energiebronnen kunnen de uitlaatemissies drastisch verminderen
Hernieuwbare energiebronnen kunnen de uitlaatemissies drastisch verminderen Rags-to-riches Skoda overweegt verkoopproblemen na Brexit
Rags-to-riches Skoda overweegt verkoopproblemen na Brexit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

