
Wetenschap
Hoe langzame spiervezels hun buren overtuigen om zich bij hen aan te sluiten
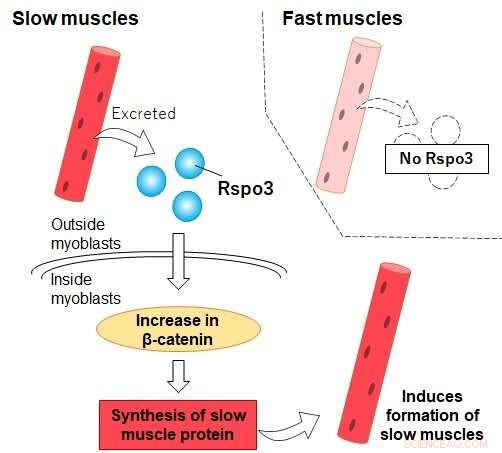
Rspo3 wordt uitgescheiden uit "trage" type I-vezels (niet uit "snelle" vezels), wat de ophoping van bèta-catenine in myoblasten bevordert. Dit leidt tot een verhoogde productie van MyHC I en de uiteindelijke differentiatie van de myoblast tot een type I-vezel. Krediet:Tokyo Metropolitan University
Onderzoekers van de Tokyo Metropolitan University hebben ontdekt dat een eiwit dat wordt uitgescheiden door type I (trage) spiervezels, de sleutel tot spieruithoudingsvermogen, ervoor kan zorgen dat omliggende myoblasten differentiëren tot type I vezels. Dit zet de heersende wijsheid op zijn kop die zegt dat onze snelle/langzame vezelverhouding niet significant kan worden veranderd. Ze identificeerden ook de chemische route waarmee het eiwit differentiatie beïnvloedt. Dergelijke bevindingen kunnen op een dag leiden tot therapieën om de langzame spiergezondheid onder controle te houden.
Skeletspierweefsel bestaat uit honderdduizenden vezels die op commando samentrekken. Ze zijn echter niet allemaal hetzelfde. Er zijn "trage" type I-spiervezels, belangrijk voor uithoudingsoefeningen, en "snelle" type II-vezels, die veel sneller kunnen reageren, maar voor kortere tijdsperioden. Type I-vezels kunnen worden vergeleken met marathonlopers, terwijl type II-vezels sprinters kunnen worden genoemd. Lange tijd was de heersende wijsheid dat de verhouding van type I tot type II vezels in onze spieren grotendeels bepaald wordt bij de geboorte.
Maar wetenschappers beginnen te ontdekken dat dit niet het geval is. Een team van onderzoekers van de Tokyo Metropolitan University onder leiding van professor Nobuharu Fujii heeft nu ontdekt dat een eiwit dat wordt uitgescheiden door type I-spier, bekend als R-spondin3 (Rspo3), de sleutel kan zijn tot de ontwikkeling van nieuwe type I-vezels. Toen myoblasten, voorlopers van spiercellen, werden behandeld met Rspo3, begonnen ze significant grotere hoeveelheden Myosin Heavy Chain I (MyHC I) te produceren, een eiwit dat wordt geproduceerd door type I-spier.
Het effect leek uniek te zijn voor myoblasten in de vroege stadia van hun ontwikkeling. Dit betekent dat type I-vezels actief de vorming van meer type I-vezels in hun omgeving induceren, Rspo3 uitscheiden en inwerken op de differentiatie van nabijgelegen cellen. De bevinding werpt een nieuw licht op de rol van spieren in ons lichaam en zet de conventionele wijsheid op zijn kop die zegt dat de verhouding van type I tot type II vezels niet kan worden veranderd. Het team kon ook aantonen dat dit gebeurde via een specifieke cascade van chemische reacties die bekend staat als de Wnt/bèta-catenine-route, die verantwoordelijk is voor de noodzakelijke accumulatie van bèta-catenine in cellen. Experimenten om bijvoorbeeld de hoeveelheid bèta-catenine in cellen kunstmatig te verminderen, leidden tot onderdrukking van verhoogde MyHC I-expressie.
Type 2-diabetes en gebrek aan lichaamsbeweging zijn twee van de vele redenen waarom langzame spiervezels kunnen atrofiëren. De bevindingen van het team suggereren dat het mogelijk is om specifiek de ontwikkeling van type I-vezels te stimuleren door middel van therapeutische middelen. Rspo3 kan bijvoorbeeld direct als behandeling worden gebruikt of worden gebruikt om spiercellen te onderscheiden die van een patiënt zijn afgenomen voordat het weefsel opnieuw wordt geplant. Als cellen Rspo3 kunnen uitscheiden en omliggende cellen kunnen aantasten, zullen de voordelen meer zijn dan alleen de massa die opnieuw wordt geïntroduceerd. Dergelijke inzichten beloven opwindende nieuwe mogelijkheden voor behandelingen om de spierfunctie te verbeteren, een belangrijke uitdaging voor de vergrijzende bevolking en de samenleving.
De studie verschijnt in Wetenschappelijke rapporten . + Verder verkennen
Spieren lijken eerder te groeien dan te krimpen bij sommige ernstig zieke COVID-patiënten
 Waterwegen van Chicago - die na meer dan 100 jaar nog steeds stromen
Waterwegen van Chicago - die na meer dan 100 jaar nog steeds stromen NASA ontdekt dat tropische storm Karen zware regen naar Puerto Rico brengt
NASA ontdekt dat tropische storm Karen zware regen naar Puerto Rico brengt Voorgeschreven branden verteren het landschap van Kansas
Voorgeschreven branden verteren het landschap van Kansas Magnitude 6.9 aardbeving slaat toe voor de kust van Alaska
Magnitude 6.9 aardbeving slaat toe voor de kust van Alaska Nieuw onderzoek onthult dat anaërobe vergisting de Britse netto-nul-emissies zou kunnen ondermijnen
Nieuw onderzoek onthult dat anaërobe vergisting de Britse netto-nul-emissies zou kunnen ondermijnen
Hoofdlijnen
- Hoe orchideeën werken
- Wat zijn de zuignappen op een octopus genoemd?
- Human Heart Science Projects
- Genetisch hulpmiddel dat een soort onder VN-beoordeling kan veroordelen
- Stappen van DNA-transcriptie
- Wat zijn endorfines?
- Wat doet de temporale kwab?
- Tropische diversiteit wortelt in relaties tussen schimmels en zaden
- Wat zou er gebeuren als de cel geen DNA had?
- G1-fase: wat gebeurt er tijdens deze fase van de celcyclus?

- Hoe geslachtsaanpassende chirurgie werkt

- Is de tweekamerige geest geëvolueerd om het moderne menselijke bewustzijn te creëren?

- Tijger botten? Leeuw botten? Een bijna uitgestorven cycad? DNA-controles ter plaatse bij aankomsthavens

- Is er een verband tussen beweging en geluk?

 Astronaut:SpaceX Dragon verslaat shuttle, Sojoez voor lancering
Astronaut:SpaceX Dragon verslaat shuttle, Sojoez voor lancering 5e graadwetenschappen Elektriciteitsexperimenten voor studenten
5e graadwetenschappen Elektriciteitsexperimenten voor studenten Er kunnen vier vijandige beschavingen in de Melkweg zijn, speculeert onderzoeker
Er kunnen vier vijandige beschavingen in de Melkweg zijn, speculeert onderzoeker Wat maakt een relatie een functie?
Wat maakt een relatie een functie?  Zwavelzuur & chloor bleekreactie
Zwavelzuur & chloor bleekreactie Multi-face tracking om AI te helpen de actie te volgen
Multi-face tracking om AI te helpen de actie te volgen Persvrijheidsgroep slaat gecensureerde artikelen op in Minecraft-bibliotheek
Persvrijheidsgroep slaat gecensureerde artikelen op in Minecraft-bibliotheek Een technologie voor drukloze sinterverbinding voor vermogenshalfgeleiders van de volgende generatie
Een technologie voor drukloze sinterverbinding voor vermogenshalfgeleiders van de volgende generatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

