
Wetenschap
Nieuwe methode stelt wetenschappers in staat om alle moleculen te bepalen die aanwezig zijn in de lysosomen van muizen
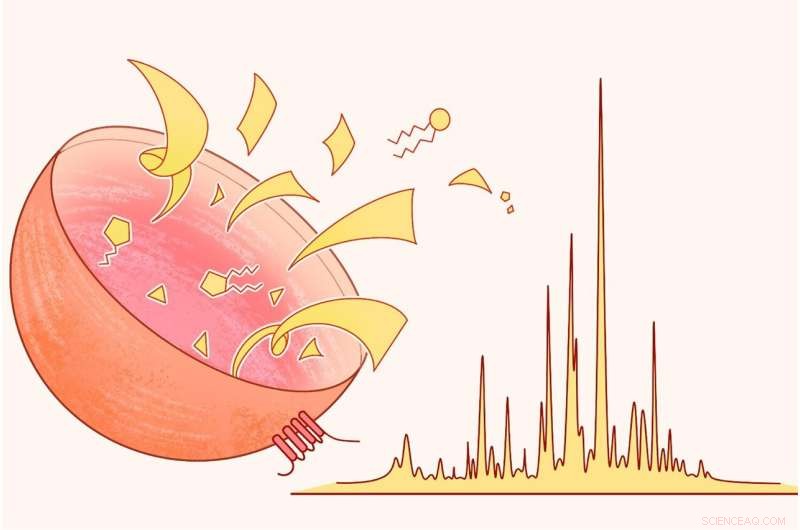
Een cartoonweergave van de nieuwe methode, waarmee wetenschappers de lysosomen (links) van elke cel in een muis kunnen isoleren om met massaspectrometrie (rechts) alle moleculen erin te analyseren en te identificeren. Krediet:Cindy Lin
Klein maar krachtig, lysosomen spelen een verrassend belangrijke rol in cellen, ondanks hun geringe grootte. Deze kleine zakjes, die slechts 1-3% van de cel in volume uitmaken, zijn de recyclingcentra van de cel, de thuisbasis van enzymen die onnodige moleculen afbreken in kleine stukjes die vervolgens opnieuw kunnen worden samengevoegd om nieuwe te vormen. Lysosomale disfunctie kan leiden tot een verscheidenheid aan neurodegeneratieve of andere ziekten, maar zonder manieren om de innerlijke inhoud van lysosomen beter te bestuderen, blijven de exacte moleculen die betrokken zijn bij ziekten - en dus nieuwe medicijnen om ze aan te pakken - ongrijpbaar.
Een nieuwe methode, gerapporteerd in Nature op 21 september kunnen wetenschappers alle moleculen bepalen die aanwezig zijn in de lysosomen van elke cel bij muizen. Door de inhoud van deze moleculaire recyclingcentra te bestuderen, kunnen onderzoekers leren hoe de onjuiste afbraak van cellulaire materialen tot bepaalde ziekten leidt. Onder leiding van Monther Abu-Remaileh van Stanford University, instituutswetenschapper aan Sarafan ChEM-H, leerde het team van het onderzoek ook meer over de oorzaak van een momenteel onbehandelbare neurodegeneratieve ziekte die bekend staat als de ziekte van Batten, informatie die zou kunnen leiden tot nieuwe therapieën.
"Lysosomen zijn zowel fundamenteel als klinisch fascinerend:ze voorzien de rest van de cel van voedingsstoffen, maar we weten niet altijd hoe en wanneer ze ze leveren, en het zijn de plaatsen waar veel ziekten, vooral die welke de hersenen aantasten, beginnen ', zei Abu-Remaileh, een assistent-professor chemische technologie en genetica.
Sommige eiwitten die zich gewoonlijk in lysosomen bevinden, zijn gekoppeld aan een aantal ziekten. Mutaties in de genetische instructies voor het maken van die eiwitten leiden tot deze 'lysosomale stapelingsstoornissen', zoals ze gezamenlijk worden genoemd, maar de functies van sommige van deze eiwitten hebben wetenschappers lang in verwarring gebracht. Informatie over hoe deze eiwitten werken, kan wetenschappers helpen betere manieren te ontwikkelen om deze ziekten te diagnosticeren, te monitoren of te behandelen.
Als wetenschappers de rol willen bestuderen die een bepaald eiwit in de cel speelt, kunnen ze de functie ervan blokkeren of stimuleren en kijken of bepaalde moleculen als reactie verschijnen of verdwijnen. Maar het bestuderen van de inhoud van lysosomen is een schaalprobleem. "Als er iets gebeurt en een molecuul groeit 200-voudig in overvloed in het lysosoom, dan zou je slechts een tweevoudige toename zien als je naar de hele cel kijkt", zegt Nouf Laqtom, eerste auteur van het onderzoek. De onthullende resultaten worden begraven in het lawaai.
Om het geluid te dempen, zouden de onderzoekers lysosomen moeten scheiden van al het andere in de cel. Ze hadden eerder een methode ontwikkeld om precies dat te doen in cellen die in laboratoria waren gekweekt, maar ze wilden een manier ontwikkelen om hetzelfde te doen bij muizen.
Vissen naar magneten
De eerste stap in hun zoektocht om lysosomen te isoleren, was het aanbrengen van een kleine verandering in de genen van de muizen om een kleine moleculaire tag op het oppervlak van elk lysosoom in het hele dier te installeren. Op elk moment dat ze willen stoppen en de moleculen in de lysosomen van de muis willen controleren, zoals na het vasten of het voeren van een specifiek voedsel, zetten ze de tag in de cellen die ze willen onderzoeken aan en verwijderen dan het weefsel en malen het voorzichtig. omhoog om de cellen open te breken zonder de lysosomen binnenin te verstoren.
Om lysosomen uit het cellulaire slib te vissen, vertrouwt het team op magneten. Aan hun slurry voegen ze kleine magnetische kralen toe die elk zijn versierd met moleculaire klemmen die de lysosomale tag vastgrijpen die ze eerder hadden geïnstalleerd. Ze kunnen selectief alle lysosomen verzamelen met behulp van een tweede magneet en vervolgens de lysosomen uit elkaar halen om de moleculen te onthullen die veilig erin waren weggestopt. Massaspectrometrie, een set hulpmiddelen die het gewicht van verschillende moleculen in een mengsel bepaalt, helpt de onderzoekers vervolgens om de individuen in hun lysosomale moleculaire potpourri te identificeren. Degenen die groeien of afnemen, wijzen wetenschappers op bepaalde paden of functies.
Afgezien van de kleine extra tag op elk lysosoom, zijn deze "LysoTag"-muizen verder normale laboratoriummuizen. Nu kan bijna elke onderzoeker deze muizen gebruiken om de rol van lysosomen bij verschillende ziekten te bestuderen.
"Deze muizen zijn vrij beschikbaar voor iedereen in de onderzoeksgemeenschap en mensen beginnen ze al te gebruiken", zei Abu-Remaileh. "We hopen dat dit de gouden standaard wordt."
Weten waar je moet kijken
Het team wilde graag hun methode toepassen om de lysosomen in hersencellen te bestuderen om de neurodegeneratieve lysosomale stapelingsziekten beter te begrijpen, te beginnen met de CLN3-ziekte of de juveniele Batten-ziekte. "We zien dit echt als een van de meest urgente problemen die we kunnen helpen oplossen", zei Abu-Remaileh.
Veroorzaakt door een mutatie in het gen dat codeert voor een eiwit genaamd CLN3, is de juveniele ziekte van Batten dodelijk en leidt het tot verlies van gezichtsvermogen, toevallen en progressieve motorische en mentale achteruitgang bij kinderen en jonge volwassenen. Het CLN3-eiwit wordt gevonden op het membraan van het lysosoom, maar niemand heeft ooit zijn functie in de cel vastgesteld of hoe zijn disfunctie tot de waargenomen symptomen leidt.
Met behulp van hun LysoTag-muizen werkten de onderzoekers samen met experts in zowel het Sarafan ChEM-H Metabolomics Knowledge Center als de Whitehead Institute Metabolomics Core Facility en vonden een dramatische toename in de hoeveelheid van een soort molecuul genaamd glycerofosfodiester, of kortweg GPD, in muizen met de CLN3-ziektemutatie. Deze GPD's worden tijdelijk gevormd tijdens de afbraak van de vetmoleculen die de membranen van elke cel in ons lichaam vormen.
In gezonde cellen hopen de GPD's zich niet op in het lysosoom; ze worden geëxporteerd naar een ander deel van de cel, waar ze vervolgens worden afgebroken tot kleinere stukjes. De onderzoekers denken nu dat het CLN3-eiwit een belangrijke rol speelt bij die export, hetzij door de moleculen direct naar buiten te brengen, hetzij door een ander eiwit te helpen dat werk te doen. Ze vonden GPD-moleculen in het hersenvocht van patiënten met CLN3-ziekte, wat suggereert dat clinici mogelijk GPD-niveaus zouden kunnen volgen om het succes van toekomstige behandelingen te meten. Het team bepaalt nu welke van de GPD-moleculen giftig kunnen zijn en hoe de eiwitten die betrokken zijn bij het maken en exporteren van GPD's met nieuwe medicijnen kunnen worden aangepakt. Ze passen hun methode ook toe om te kijken naar andere ziekten waarbij mutaties in lysosomale genen betrokken zijn, zoals de ziekte van Parkinson.
"Je kunt geen nieuwe manieren ontwikkelen om ziekten te diagnosticeren of te behandelen als je niet weet wat er in de lysosomen verandert", zegt Laqtom, een voormalig postdoctoraal wetenschapper in het Abu-Remaileh-lab. "Deze methode helpt je ervoor te zorgen dat je in de goede richting kijkt. Het wijst je op het juiste pad en zorgt ervoor dat je niet verdwaalt." + Verder verkennen
Moleculaire tags onthullen hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering
 Eiland Mayotte in de Indische Oceaan op cycloonalarm
Eiland Mayotte in de Indische Oceaan op cycloonalarm Vluchtshaming zou kunnen helpen miljarden aan geld van luchtvaartmaatschappijen vrij te maken om de Amazone en andere tropische bossen te beschermen
Vluchtshaming zou kunnen helpen miljarden aan geld van luchtvaartmaatschappijen vrij te maken om de Amazone en andere tropische bossen te beschermen Zuid-Afrikaanse koloniale dagboeken helpen klimaatwetenschappers om weerpatronen uit het verleden te reconstrueren
Zuid-Afrikaanse koloniale dagboeken helpen klimaatwetenschappers om weerpatronen uit het verleden te reconstrueren Ontbrekend ijsprobleem eindelijk opgelost
Ontbrekend ijsprobleem eindelijk opgelost Welke aanpassingen moet buffelgras maken in een nieuwe omgeving?
Welke aanpassingen moet buffelgras maken in een nieuwe omgeving?
Hoofdlijnen
- Nugget the cow:Zeewier-kauwend rund kauwt op oplossing voor methaanprobleem
- Spanje meldt geval van gekkekoeienziekte
- De structuur en functie van spiercellen
- Wisseling van de wacht - onderzoek werpt licht op hoe planten ademen
- Transcriptiefactoren en genexpressie heroverwegen
- Babymuizen met een oudere vader huilen anders, kunnen gevolgen hebben voor neurologische ontwikkelingsstoornissen
- Koeltechnologie om de levensvatbaarheid van het gekoelde muizensperma gedurende 10 dagen te behouden
- Hoe ziet een menselijke cel eruit?
- Wat is de brugfase van glycolyse?
- Boek beschrijft alle 451 families van bloeiende planten, varens, lycopoden en naaktzadigen

- Microscopie onthult mechanisme achter nieuwe CRISPR-tool
- Ziekteverwekkers identificeren die sojastamkanker veroorzaken

- Symbiotische schimmels suggereren biocontrole-implicaties voor plaagkevers

- Openbare bronnen stimuleren de ontdekking van medicijnen en bieden inzicht in de eiwitfunctie

 MATISSE om licht te werpen op de vorming van de aarde en planeten
MATISSE om licht te werpen op de vorming van de aarde en planeten Goedkope smartphonegids:van iPhone tot Google Pixel of Samsung Galaxy, dit is wat je krijgt voor $ 399 en minder
Goedkope smartphonegids:van iPhone tot Google Pixel of Samsung Galaxy, dit is wat je krijgt voor $ 399 en minder Een nieuw begrip van connectiviteit en bio-erfgoed
Een nieuw begrip van connectiviteit en bio-erfgoed Uitdunnen van bossen geen verdediging tegen branden
Uitdunnen van bossen geen verdediging tegen branden Hoe een ascorbinezuuroplossing te maken
Hoe een ascorbinezuuroplossing te maken Hoe zorgen Jaguars voor hun baby's?
Hoe zorgen Jaguars voor hun baby's?  Student maakt draagbare portemonnee om medicijnen koel te houden na geïnspireerd te zijn door het verhaal van vriendinnen
Student maakt draagbare portemonnee om medicijnen koel te houden na geïnspireerd te zijn door het verhaal van vriendinnen Reclame gaat er nog steeds van uit dat moeders kennis alleen gebruiken voor huishoudelijke zorg
Reclame gaat er nog steeds van uit dat moeders kennis alleen gebruiken voor huishoudelijke zorg
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

