
Wetenschap
Chemici ontwikkelen motion capture-achtige technologie voor het volgen van eiwitvorm
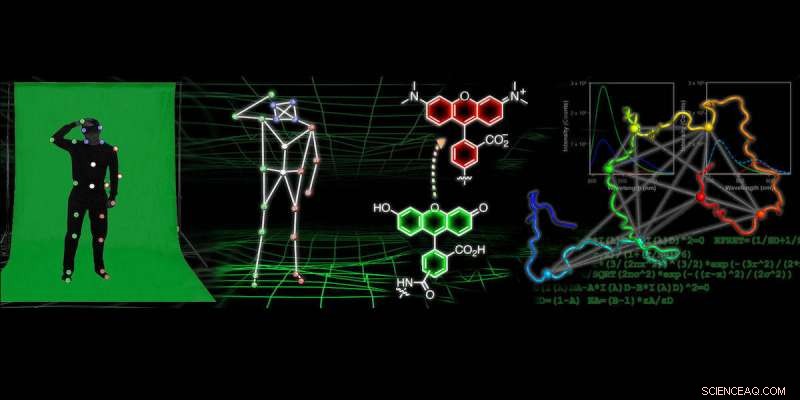
Krediet:Universiteit van Pennsylvania
In veel moderne animatiefilms, de truc om realistische bewegingen voor individuele personages en objecten te bereiken, ligt in motion-capture-technologie. Dit proces houdt vaak in dat iemand een trainingspak draagt dat bedekt is met kleine, gekleurde ballen terwijl een camera de positie van die gekleurde ballen vastlegt, die vervolgens wordt gebruikt om weer te geven hoe de persoon beweegt.
Onderzoekers van de Universiteit van Pennsylvania ontwikkelen een vergelijkbare technologie om 'films' met atomaire resolutie te verkrijgen die volgen hoe eiwitten vouwen en van vorm veranderen. Om deze films te genereren, de wetenschappers labelen het eiwit met sondes op veel posities en observeren de beweging van die labels. De fluorescentiegegevens over de relatieve posities van de sondes kunnen vervolgens worden gebruikt om computationele modellen van de eiwitstructuur in atomaire details te construeren. Dit onderzoek zou kunnen leiden tot verbeteringen in geneesmiddelen die worden gebruikt voor de behandeling van neurodegeneratieve ziekten, evenals nieuwe beeldvormingsmethoden die zouden kunnen leiden tot een eerdere detectie.
Het onderzoek was een multidisciplinaire inspanning onder leiding van E. James Petersson. De krant is gepubliceerd in Biofysisch tijdschrift .
"Een van de grote fundamentele vragen in de biochemie is hoe eiwitten zich in een bepaalde vorm vouwen, " zei Petersson, "en dit wordt bepaald door de volgorde van aminozuren in het eiwit. De informatie in alle interacties van de aminozuurzijketens leidt er op de een of andere manier toe dat het in een juiste vorm vouwt."
In gezonde scenario's, Petersson zei, die juiste vorm zorgt ervoor dat het eiwit verschillende functies kan hebben, zoals het transporteren van zuurstof in het bloed of het worden van "moleculaire machines" die uiteindelijk leiden tot spierbewegingen, zoals die nodig zijn voor wandelen en hardlopen.
Maar in bepaalde ziektetoestanden, vooral bij neurodegeneratieve ziekten zoals de ziekte van Alzheimer en Parkinson, de eiwitten vouwen verkeerd in een ongezonde vorm, waardoor meerdere kopieën van de eiwitten kunnen aggregeren tot "spaghetti-achtige kluwens of lange fibrillen." Deze fibrillen, Petersson zei, zijn giftig voor neuronen, die ten grondslag liggen aan de ziekte van Alzheimer en Parkinson.
"Omdat dit allemaal gepaard gaat met het vouwen van eiwitten in een bepaalde vorm, dan willen we de veranderingen in de vorm van eiwitten volgen, " zei hij. "Er zijn een aantal verschillende technieken die kunnen worden gebruikt om dit te doen, maar we houden van fluorescentie omdat je fluorescentiegegevens snel genoeg kunt verkrijgen om eiwitten in realtime te kunnen zien vouwen. Uiteindelijk willen we proberen te kijken hoe eiwitten zich in cellen vouwen."
Om informatie te krijgen over de eiwitvorm met behulp van fluorescerende sondes, onderzoekers gebruiken een techniek die fluorescentieresonantie-energieoverdracht wordt genoemd, wat vereist dat ze veel afstanden tussen verschillende punten op het eiwit meten en die informatie vervolgens gebruiken om de vorm ervan te begrijpen, vergelijkbaar met motion capture-technologie.
In deze krant, de onderzoekers deden ongeveer 30 metingen van verschillende afstanden binnen het eiwit alfa-synucleïne onder verschillende toestanden waar het van vorm verandert. Vervolgens gebruikten ze die verzameling afstandsmetingen in combinatie met complexe computationele modellering om atomaire resolutiestructuren van de vorm van het eiwit te krijgen.
Ferrie ontving een beurs van de Parkinson's Disease Foundation om de zomer door te brengen in het laboratorium van David Baker aan de Universiteit van Washington, waar Rosetta, een van de meest gebruikte programma's voor het modelleren van eiwitten, was ontwikkeld.
"Rosetta is ontworpen om stabiele, goed gevouwen eiwitten te modelleren, "Petersson zei, "geen ongeordende eiwitten die van vorm kunnen veranderen, dus moest Jack veel zelf de code herschrijven om deze weerbarstige eiwitten te kunnen modelleren."
Ferrie en Yoon hebben een reeks experimentele metingen gedaan die kunnen worden gebruikt om de eiwitvouwing te sturen om consistent te zijn met de experimentele metingen, waardoor hij de eiwitvorm kon modelleren.
Omdat het een nieuwe aanpak was, de onderzoekers wilden aantonen dat de structuren die uit de rekenmodellen komen, consistent waren met de werkelijkheid. Om dit te doen, ze voerden drie soorten experimenten uit om echte gegevens te matchen met de modellen die uit deze fluorescentie-experimenten kwamen.
Ze werkten samen met de groep van Rhoades om de gemodelleerde structuren te valideren met behulp van fluorescentiemetingen van één molecuul door Pan. Werkend in de groep van Fakhraii, Lin, gebruikte een ander type techniek genaamd atomic force microscopie om het eiwit in beeld te brengen en de modellen te valideren. Chris Dobson, een professor in de chemie aan de universiteit van Cambridge, gedeelde kernmagnetische resonantiegegevens over alfa-synucleïne die de nauwkeurigheid van de computermodellen verder bevestigden.
Het papier vertegenwoordigt een van de grootste bibliotheken van eiwitten die zijn gelabeld met synthetische fluoroforen die tot nu toe zijn gerapporteerd. Volgens Petersson, de onderzoekers moesten veel afstandsmetingen doen over verschillende regio's van het eiwit om voldoende gegevens te hebben om rekenmodellen te genereren. Ferrie en Haney moesten een gestroomlijnde benadering bedenken om verschillende sets sondes te bevestigen die over verschillende afstanden zouden werken.
De onderzoekers werken nu aan het toepassen van deze techniek om de eiwitstructuur te modelleren in de geaggregeerde vormen die giftig zijn voor neuronen en om de reactie ervan op medicijnen te modelleren die ervoor zouden zorgen dat het van vorm zou veranderen, deze samenvoeging te voorkomen.
"Het vermogen om een eiwit te zien terwijl het van vorm verandert, " zei Petersson, "en om daar daadwerkelijk structuren uit te halen, is een heel belangrijk fundamenteel wetenschappelijk doel waar we al 10 jaar naartoe werken. Er zijn enkele zeer indrukwekkende doorbraken geweest in het verkrijgen van structuren van eiwitten in neurodegeneratieve ziekten, maar de fluorescentietechniek heeft het potentieel om dat te doen in levende cellen, waartoe geen enkele andere techniek in staat is."
Volgens Petersson, eiwitten die meerdere vormen aannemen, verschillende exemplaren op elkaar stapelen en samenvoegen, zoals ze doen bij neurodegeneratieve ziekten, zijn een belangrijk fundamenteel biochemisch probleem dat andere structurele biologietechnieken niet echt kunnen aanpakken. Een beter begrip van hoe dat werkt en wat die vormen zijn, heeft de potentie om een impact te hebben op ziekten zoals Parkinson en om onderzoekers de kans te geven uit te zoeken hoe geneesmiddelen of diagnostische modellen interageren met het eiwit.
"We werken eraan om modelstructuren te genereren die daadwerkelijk laten zien wat het effect is van deze medicijnen, " Petersson said. "We take the protein with the fluorescent labels, add the drug, allow the protein to change shape, make fluorescence measurements and then take those back to the computational modeling so we can actually see the structural effect of these drugs. Hopefully this will lead to more of a rational understanding so that better second and third generation drugs can be made."
The researchers are also collaborating with Robert Mach, the Britton Chance Professor of Radiology in Penn's Perelman School of Medicine. Mach's group is interested in developing positron emission tomography imaging probes that can be used to bind to the aggregated forms of proteins and image them in patients.
"There are some promising drugs for treating neurodegenerative diseases such as Alzheimer's and Parkinson's, that could block this formation of aggregates, " Petersson said, "but the problem is that, by the time people show cognitive or motor-tremor symptoms, it's too late to use these drugs because there's already too much neurodegeneration. If you're getting aggregates in your brain, even if you're not showing any behavioral changes or learning deficits, these probes could noninvasively image the aggregates. By achieving a rational understanding of what the protein structure is, we hope we can help with that work moving forward."
 Wetenschappers bouwen M29-clustermodelkatalysator
Wetenschappers bouwen M29-clustermodelkatalysator De weg verlichten voor het verwijderen van radioactieve elementen
De weg verlichten voor het verwijderen van radioactieve elementen Priming-effect veroorzaakt door wortelafval varieert met de wortelvolgorde
Priming-effect veroorzaakt door wortelafval varieert met de wortelvolgorde Synthetische fysiologen ontwikkelen nieuwe receptor uitgeschakeld door groen licht
Synthetische fysiologen ontwikkelen nieuwe receptor uitgeschakeld door groen licht Robotchemicus geeft inzicht in de oorsprong van het leven
Robotchemicus geeft inzicht in de oorsprong van het leven
 Krachtig, lokale verhalen kunnen ons inspireren om actie te ondernemen tegen klimaatverandering
Krachtig, lokale verhalen kunnen ons inspireren om actie te ondernemen tegen klimaatverandering Wat eet Aziatische damekevers?
Wat eet Aziatische damekevers?  Dodelijkste bosbranden in de Verenigde Staten sinds de jaren negentig
Dodelijkste bosbranden in de Verenigde Staten sinds de jaren negentig wetenschappers, Zo gebruik je minder plastic
wetenschappers, Zo gebruik je minder plastic Uw houtkachel heeft meer invloed op het klimaat dan u denkt
Uw houtkachel heeft meer invloed op het klimaat dan u denkt
Hoofdlijnen
- Hoe hersenspoeling werkt
- Nieuwe procedure voor snellere detectie van milieueffecten van zalmkwekerijen
- Te veel charisma kan de effectiviteit van een leider schaden
- Evolutie in je achtertuin - koolmezen passen hun snavel misschien aan aan vogelvoeders
- Productietijden kunnen het illegaal witwassen van wilde dieren tegengaan
- Wat is de basis voor uitzonderingen op het Aufbau-principe?
- Radiometrische datering: definitie, hoe werkt het, gebruik & voorbeelden
- Stappen van DNA Transcriptie
- Gemakkelijke manieren om botten te herkennen in anatomie
- Zullen lithium-luchtbatterijen ooit vliegen?

- Nieuwe software brengt cryo-EM-kaarten met een lagere resolutie in beeld

- Onderzoekers creëren de meest verwarde, in elkaar grijpende molecule ooit
- Efficiënte kettingoverdracht voor 3D-printen van taaie fotopolymeren

- In kaart brengen en meten van eiwitten op de oppervlakken van endoplasmatisch reticulum (ER) in cellen

 Auto's:overgang van lockdown is een splitsing in de weg - hier zijn twee mogelijke uitkomsten voor toekomstige reizen
Auto's:overgang van lockdown is een splitsing in de weg - hier zijn twee mogelijke uitkomsten voor toekomstige reizen Nieuw overstromingsrisico geïdentificeerd door FIU-onderzoeker
Nieuw overstromingsrisico geïdentificeerd door FIU-onderzoeker Het tijdperk van fossiele brandstoffen loopt ten einde, maar de rechtszaken zijn nog maar net begonnen
Het tijdperk van fossiele brandstoffen loopt ten einde, maar de rechtszaken zijn nog maar net begonnen Kwantumsprong voor snelheidslimieten
Kwantumsprong voor snelheidslimieten Canadese provincies ruziën over pijpleidingproject in de Stille Oceaan
Canadese provincies ruziën over pijpleidingproject in de Stille Oceaan Hoe de grote Zweedse bosbrand van 2014 het ecosysteem beïnvloedde
Hoe de grote Zweedse bosbrand van 2014 het ecosysteem beïnvloedde Meer dan een strook verf nodig om fietsers veilig te houden
Meer dan een strook verf nodig om fietsers veilig te houden Onderzoek onthult problemen met vervalsing in wervingsprocessen in het hoger onderwijs
Onderzoek onthult problemen met vervalsing in wervingsprocessen in het hoger onderwijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

