
Wetenschap
Biochemici onderzoeken het transport van grote eiwitten door bacteriële celmembranen
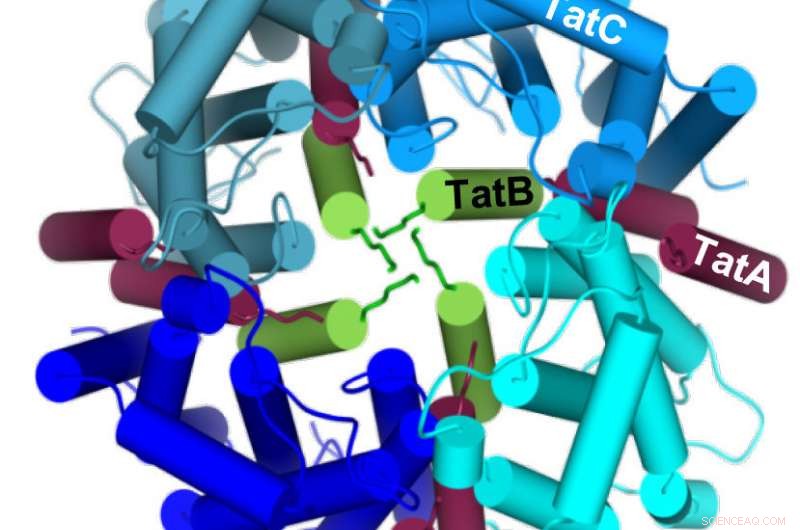
Vier TatC-moleculen (blauw) vormen een cirkel rond vier TatB-moleculen (groen) om in het midden een holte te vormen waarin het te transporteren eiwit van onderaf kan worden ingebracht. Credit: Tijdschrift voor biologische chemie
Elke cel is omgeven door een membraan, dat zorgt voor het interne biochemische milieu en regelt de uitwisseling van stoffen met zijn omgeving. In elk celmembraan er zijn een groot aantal transporteurs die slechts één soort molecuul doorlaten. In het geval van zeer kleine moleculen, zoals water, de verantwoordelijke transporters vormen kleine poriën in het membraan, die onmiddellijk na het proces verdwijnen. Maar hoe worden duizenden keren grotere eiwitten door membranen getransporteerd zonder dat er een groot lek ontstaat?
In een recente studie, een team onder leiding van Prof. Dr. Matthias Müller van het Institute for Biochemistry and Molecular Biology en het speciale onderzoeksgebied 746 samen met Prof. Dr. Bettina Warscheid van het Institute of Biology II en het Cluster of Excellence BIOSS Center for Biological Signalling Studies bij de Universiteit van Freiburg ontdekte details over de structuur van zo'n transporter voor eiwitmoleculen. Hun bevindingen zijn gepubliceerd in Tijdschrift voor biologische chemie .
De onderzoekers bestudeerden de zogenaamde Tat-transporter die in het celmembraan van bacteriën voorkomt en bepaalde eiwitten exporteert, de Tat-substraten, uit hen. De transporter bestaat uit drie componenten genaamd TatA, TatB en TatC. Ze zijn in rusttoestand over het membraan verdeeld en worden alleen tot een actieve transporter geassembleerd wanneer een Tat-substraat aan TatC bindt. Er is tot nu toe weinig bekend over hoe de drie componenten samensmelten.
In een eerdere studie, de onderzoekers hadden ontdekt dat de chemische stof dicyclohexylcarbodiimide (DCCD) het Tat-transport blokkeerde. De wetenschappers hebben nu een specifieke positie op TatC geïdentificeerd die chemisch kan worden gewijzigd door DCCD, wat op zijn beurt contact met het Tat-substraat remt. De positie bevindt zich niet op het TatC-oppervlak, maar eerder in een deel dat diep in het membraan verborgen is. Dus, DCCD remt de primaire koppeling van het Tat-substraat niet, maar eerder de diepe penetratie in het membraan langs het TatC-molecuul. Dus, de teams konden aantonen dat de assemblage van verschillende TatC- en TatB-componenten een holte creëert waarin het Tat-substraat vanaf één kant van het membraan wordt ingevoegd. Het is pas in de volgende stap, die nog moet worden uitgelegd, dat deze holte naar buiten opengaat waarvoor TatA dan nodig is.
De Tat-transporter zou in de toekomst kunnen dienen om nieuwe soorten antibiotica te ontwikkelen:sommige bacteriën die schadelijk zijn voor de mens gebruiken het Tat-transport om eiwitmoleculen te exporteren waarmee ze contact leggen met menselijke gastheercellen. Ideaal, een antibioticum zou alleen het metabolisme van bacteriën moeten remmen en niet dat van patiënten. Omdat de Tat-transporter niet voorkomt in menselijke cellen, het zou dus een geschikt antibioticumdoelwit zijn.
 Baking Soda gebruiken om HCL te neutraliseren
Baking Soda gebruiken om HCL te neutraliseren  Programmeren van Van der Waals-interacties met complexe symmetrieën in microdeeltjes met behulp van vloeibare kristalliniteit
Programmeren van Van der Waals-interacties met complexe symmetrieën in microdeeltjes met behulp van vloeibare kristalliniteit Supercomputers simuleren nieuwe paden voor mogelijke behandeling van RNA-virussen
Supercomputers simuleren nieuwe paden voor mogelijke behandeling van RNA-virussen Labtechnologie brengt Nobelprijswinnaar cryo-EM scherper in beeld
Labtechnologie brengt Nobelprijswinnaar cryo-EM scherper in beeld Een model van een atoom maken van Styrofoam
Een model van een atoom maken van Styrofoam
 Unieke virtuele 3D-omgevingen met de nieuwe LIME v2.0-software en V3Geo-cloudopslag
Unieke virtuele 3D-omgevingen met de nieuwe LIME v2.0-software en V3Geo-cloudopslag Wat voor soort Symmetrie heeft een Hydra?
Wat voor soort Symmetrie heeft een Hydra?  Aardbevingsfysica op meerdere schalen
Aardbevingsfysica op meerdere schalen Uitbraken van koraalziekte fluctueren met El Niño-jaren, nieuwe onderzoeksresultaten
Uitbraken van koraalziekte fluctueren met El Niño-jaren, nieuwe onderzoeksresultaten Hoe een groeiende bevolking gezond voedsel te geven zonder de planeet te verpesten?
Hoe een groeiende bevolking gezond voedsel te geven zonder de planeet te verpesten?
Hoofdlijnen
- Meer dan 38 procent van de Neotropische papegaaienpopulatie op het Amerikaanse continent wordt bedreigd door menselijke activiteit
- Hoe communiceren de lever en de nieren en welke hormonen worden gebruikt?
- Snelle reactie van Fish op klimaatverandering
- Onderzoek wijst op noodzaak van nieuwe aanpak van verlammende paardenziekte
- Apenstudie toont een pad naar het monitoren van bedreigde diersoorten
- Instrumenten gebruikt in de biologie
Biologen en biologiestudenten gebruiken verschillende instrumenten in hun werk om kennis over levende wezens te verzamelen. Deze instrumenten en hulpmiddelen worden elk jaar gedetailleerder en hightech, evenals
- Waarvoor gebruikt het lichaam nucleïnezuren?
- 5 waargebeurde verhalen over een bij de geboorte gescheiden tweeling
- Infectieziekten:CTRL + ALT + Delete
- Nieuw record:3D-geprinte optisch-elektronische integratie
- Ingenieurs vinden dat flessenborstelcopolymeren kunnen worden aangepast voor toepassingen

- Wetenschappers hebben nieuwe verbindingen met mogelijk antitumoreffect verkregen uit zeespons

- Afbeelding:Plastic sparrenbos

- Sensor detecteert vleugje slechte adem

 Wetenschappers gebruiken licht om virale activiteit om te schakelen en ladingen naar cellen te brengen
Wetenschappers gebruiken licht om virale activiteit om te schakelen en ladingen naar cellen te brengen Virtual reality gebruikt om uraniumverontreiniging te benadrukken
Virtual reality gebruikt om uraniumverontreiniging te benadrukken Majestueuze WWII Spitfire vertrekt op wereldvlucht
Majestueuze WWII Spitfire vertrekt op wereldvlucht China stuurt laaggeplaatste functionaris naar veiligheidsconferentie
China stuurt laaggeplaatste functionaris naar veiligheidsconferentie Citroenaccu-informatie
Citroenaccu-informatie  Natuurkundigen leiden elektromagnetische golven langs een oneindig kleine lijn
Natuurkundigen leiden elektromagnetische golven langs een oneindig kleine lijn Hoe een kwantumcomputer te certificeren
Hoe een kwantumcomputer te certificeren De Amerikaanse wetenschap wordt samen met de federale overheid stopgezet
De Amerikaanse wetenschap wordt samen met de federale overheid stopgezet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

