
Wetenschap
Een nieuw type superresolutie voor het onderzoeken van celdeling
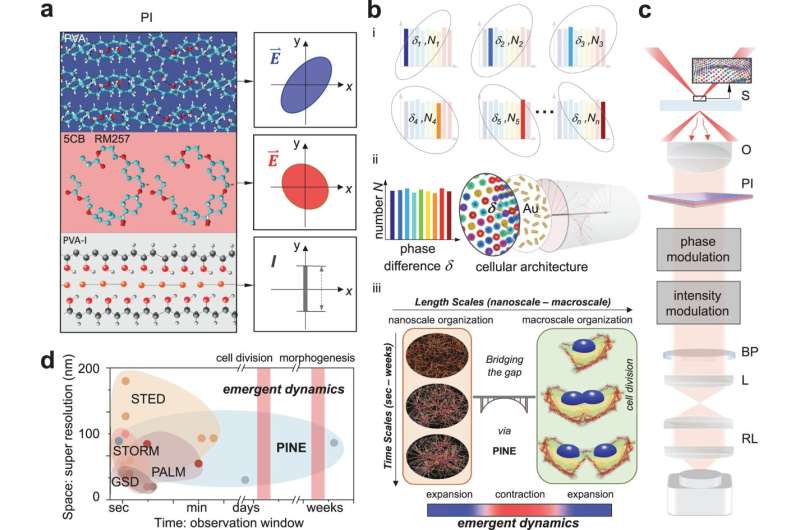
Een nieuwe manier om details te zien die kleiner zijn dan de helft van de golflengte van licht heeft onthuld hoe steigers op nanoschaal in cellen tijdens celdeling een brug vormen naar de macroschaal. In tegenstelling tot eerdere superresolutietechnieken, is de techniek die is ontwikkeld en getest aan de Universiteit van Michigan niet afhankelijk van moleculen die bij langdurig gebruik verslijten.
Superresolutie kan structuren tot 10 nanometer onthullen, of ongeveer dezelfde breedte als 100 atomen. Het opende een hele nieuwe wereld in de biologie, en de technieken die dit voor het eerst mogelijk maakten, kregen in 2014 een Nobelprijs. Het zwakke punt is echter dat het alleen momentopnamen van tientallen seconden kan maken. Dit maakt het onmogelijk om de evolutie van de machinerie van een cel over langere tijdsperioden waar te nemen.
"We vroegen ons af:wanneer het systeem als geheel zich deelt, hoe interageren structuren op nanometerschaal met hun buren op nanometerschaal, en hoe schaalt deze interactie zich op naar de hele cel?" vroeg Somin Lee, universitair docent elektrotechniek en computertechniek aan de U-M, die leiding gaf aan het onderzoek dat werd gepubliceerd in Nature Communications .
Om die vraag te beantwoorden hadden Lee en zijn collega's een nieuw soort superresolutie nodig. Met hun nieuwe methode konden ze een cel 250 uur lang continu monitoren.
"De levende cel is een drukke plek waar hier en daar eiwitten bruisen. Onze superresolutie is zeer aantrekkelijk voor het bekijken van deze dynamische activiteiten", zegt Guangjie Cui, een Ph.D. student elektrotechniek en computertechniek en co-eerste auteur van het onderzoek samen met Yunbo Liu, een Ph.D. afgestudeerd in elektrotechniek en computertechniek.
Net als de originele methode maakt de nieuwe techniek gebruik van sondes in de buurt van interessante objecten op nanoschaal om er licht op te werpen. Superresolutie 1.0 maakte hiervoor gebruik van fluoroforen, fluorescerende moleculen die na bestraling een antwoordend licht uitzonden. Als de fluoroforen dichter bij elkaar zouden zijn dan de grootte van wat er ook werd afgebeeld, zou het beeld kunnen worden gereconstrueerd op basis van de lichtflitsen die door de fluoroforen worden geproduceerd.
De nieuwe techniek maakt gebruik van gouden nanostaafjes, die niet kapot gaan bij herhaalde blootstelling aan licht, maar het gebruik van het licht dat ermee interageert is een grotere uitdaging. Nanostaafjes reageren op de fase van het licht, of waar het zich bevindt in de op en neergaande oscillatie van de elektrische en magnetische velden waaruit het bestaat. Deze interactie hangt af van de hoek waarin het nanostaafje staat ten opzichte van het binnenkomende licht.
Net als de fluoroforen kunnen de nanostaafjes zich hechten aan bepaalde celstructuren met gerichte moleculen op hun oppervlak. In dit geval zochten de nanostaafjes naar actine, een eiwit dat structuur toevoegt aan zachte cellen. Actine heeft de vorm van vertakte filamenten, elk met een diameter van ongeveer 7 nanometer (miljoenste van een millimeter), hoewel ze met elkaar verbonden zijn en duizenden nanometers bestrijken. Hoewel de nanostaafjes vaak meer dan tweemaal de diameter van de actine hebben, kunnen de gegevens die ze als groep leveren de kleine details ervan verhelderen.
Om de nanostaafjes te lokaliseren, bouwde het team filters gemaakt van dunne lagen polymeren en vloeibare kristallen. Deze filters maakten de detectie van licht met een bepaalde fase mogelijk, waardoor het team nanostaafjes kon onderscheiden met bepaalde hoeken ten opzichte van het binnenkomende licht. Door 10 tot 30 afbeeldingen te maken – elk met een andere subset van nanostaafjes – en deze samen te voegen tot één afbeelding, kon het team de details op nanometerschaal van de filamenten in de cellen afleiden. Deze details zouden bij conventionele microscopen onscherp zijn.
Met behulp van deze techniek ontdekte het team drie regels die de manier bepalen waarop actine zichzelf organiseert tijdens celdeling:
- Actine breidt zich uit om zijn buren te bereiken wanneer de actinefilamenten ver uit elkaar liggen.
- Actine zal dichter bij zijn buren komen om de verbindingen te vergroten, hoewel deze neiging wordt getemperd door de drang om uit te breiden en meer buren te bereiken.
- Als gevolg daarvan heeft het actinenetwerk de neiging samen te trekken als het meer verbonden is, en uit te breiden als het minder verbonden is.
Het gedrag van de actine is verbonden met het gedrag van de cel, maar de cel trekt samen als de actine uitzet, en zet uit als de actine samentrekt. Het team wil dit verder onderzoeken en ontdekken waarom de bewegingen op verschillende schalen tegengesteld zijn. Ze willen ook de gevolgen onderzoeken van het ontregelen van dit moleculaire proces:ligt dit aan de basis van sommige ziekten?
Meer in het algemeen hopen ze superresolutie te gebruiken om te begrijpen hoe zelforganisatie in biologische structuren is ingebouwd, zonder de noodzaak van centrale controle.
"Onze genetische code bevat eigenlijk niet genoeg informatie om elk detail van het organisatieproces te coderen," zei Lee. "We willen de mechanismen onderzoeken van collectief gedrag zonder centrale coördinatie, die lijken op vogels die in formatie vliegen – waarbij het systeem wordt aangedreven door interacties tussen individuele onderdelen."
Meer informatie: Guangjie Cui et al., Phase Intensity Nanoscope (PINE) opent langdurige onderzoeksvensters van levende materie, Nature Communications (2023). DOI:10.1038/s41467-023-39624-w
Journaalinformatie: Natuurcommunicatie
Aangeboden door Universiteit van Michigan
 Wetenschappers creëren katalysatoren met één atoom voor efficiënte elektro-oxidatie van water
Wetenschappers creëren katalysatoren met één atoom voor efficiënte elektro-oxidatie van water  Onderzoekers rapporteren eerste 3D-structuur van DHHC-enzymen
Onderzoekers rapporteren eerste 3D-structuur van DHHC-enzymen Hoe de pH te bepalen van pKa
Hoe de pH te bepalen van pKa Video:Zijn ammoniakmotoren de weg van de toekomst?
Video:Zijn ammoniakmotoren de weg van de toekomst?  Onderzoekers ontwerpen transistors op basis van ionische gel gemaakt van een geleidend polymeer
Onderzoekers ontwerpen transistors op basis van ionische gel gemaakt van een geleidend polymeer
Hoofdlijnen
- 10 oudst bekende ziekten
- Conserveringsonderzoek gebruikt kleine loopbanden om het uithoudingsvermogen van de zeeschildpadden te testen
- Voeding door mensen verandert het gedrag en de fysiologie van groene schildpadden op de Canarische Eilanden
- Studie meldt eerste bewijs van sociale relaties tussen chimpansees en gorilla's
- Wetenschappers ontwikkelen kleverige pesticiden om plaaginsecten te bestrijden
- Australisch onderzoek bewijst dat mensen het meest angstaanjagende roofdier van de planeet zijn
- Die vogels die neerstortten en stierven? Het waren geen dampen
- Team levert nieuwe basisgegevens over zeeluipaarden, mysterieuze toproofdieren van Antarctica
- Prehistorische vrouwen waren sterker dan de elite vrouwelijke atleten van vandaag
- Onderzoekers creëren nanobuisjes met twee segmenten met verschillende halfgeleidende domeinen

- Onderzoekers breiden zoektocht naar nieuwe staat van materie uit

- Onderzoekers maken 's werelds grootste DNA-origami

- Sommige nanodeeltjes die vaak aan consumentenproducten worden toegevoegd, kunnen DNA aanzienlijk beschadigen

- Biocompatibele TeSex-nanolegeringen voor PT/PA/CT/PET-beeldgestuurde NIR-II-fotothermische therapie
 Structuur van supercomplex van fotosysteemproteïne van diatomeeën onthult zijn zeer geavanceerde energieoverdrachtsnetwerk
Structuur van supercomplex van fotosysteemproteïne van diatomeeën onthult zijn zeer geavanceerde energieoverdrachtsnetwerk Onderzoekers overwinnen technische hindernissen op zoek naar goedkope, duurzame elektronica en zonnecellen
Onderzoekers overwinnen technische hindernissen op zoek naar goedkope, duurzame elektronica en zonnecellen Kunnen insectenlarven helpen bij het oplossen van verkrachtingsmoordzaken?
Kunnen insectenlarven helpen bij het oplossen van verkrachtingsmoordzaken? Reptielen die levend geboren worden
Reptielen die levend geboren worden De grenzen van kooldioxidefixatie verleggen
De grenzen van kooldioxidefixatie verleggen Nieuwe prikkels kunnen de automarkt elektriseren, maar er blijven oude obstakels bestaan
Nieuwe prikkels kunnen de automarkt elektriseren, maar er blijven oude obstakels bestaan Onderzoekers ontwikkelen zachte kleppen om volledig zachte robots te maken
Onderzoekers ontwikkelen zachte kleppen om volledig zachte robots te maken Je zonnebrandcrème kan de oceaan vervuilen, maar algen kunnen een natuurlijk alternatief bieden
Je zonnebrandcrème kan de oceaan vervuilen, maar algen kunnen een natuurlijk alternatief bieden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

