
Wetenschap
Nieuwe vloeibare metaalnanodeeltjes voor foto-immunotherapie bij kanker gesynthetiseerd
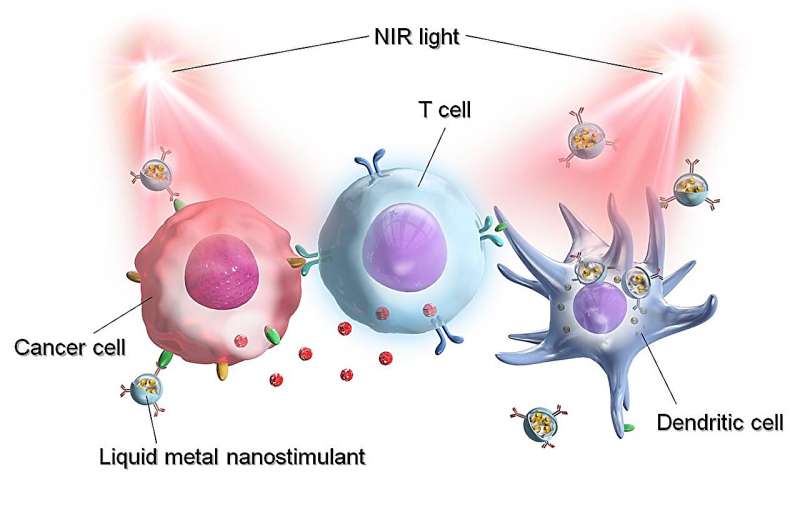
Eerst bereidde het onderzoeksteam waterdispergeerbare LM-nanodeeltjes voor via een eenvoudig eenstaps-sonicatieproces met behulp van DSPE-PEG2000 -NH2 IMIQ introduceren. Dit wordt als een enorme doorbraak beschouwd, omdat EGaIn LM van nature een niet met water mengbaar materiaal is.
Verder onderzoek bevestigde dat LM uiteenvalt om de levering van IMIQ aan het doelwit te garanderen. Bovendien vertoonde het geprepareerde nanodeeltje een lineaire toename in absorptie in het nabij-infrarode (NIR) gebied bij 808 nm, wat de optisch activeerbare aard ervan bevestigt.
Toen de waterige oplossing van het LM-nanodeeltje werd bestraald door de NIR-laser (808 nm), observeerde het team een opmerkelijke stijging van de temperatuur van de oplossing, die evenredig was met de toename van de concentratie van de nanodeeltjes. Deze bevindingen bevestigden dat PEG-IMIQ-LM nanodeeltje een robuuste en stabiele fotothermische medicijndrager was, geschikt voor immunotherapie.
Uit verdere experimenten bleek dat LM-nanodeeltjes uiterst veilig waren en geen cytotoxiciteit veroorzaakten in cellen van menselijke fibroblasten (MRC5) en darmkanker van muizen (Colon26).
Om de mate van internalisatie en distributie van de deeltjes te beoordelen, werd een fluorescerende kleurstof bekend als indocyaninegroen (ICG) in het deeltje geïntroduceerd door middel van sonicatie, resulterend in een PEG – ICG – IMIQ – LM-deeltje. Fluorescentie (FL) microscopie uitgerust met een laserstraal toonde aan dat het LM-deeltje sterke fluorescentie vertoonde bij verschillende NIR-golflengten en onmiddellijk de Colon26-cellen vernietigde. LM-deeltjes zouden dus niet alleen op efficiënte wijze de immunomodulerende stof kunnen afleveren, maar zouden ook realtime tracking mogelijk kunnen maken en specifieke kankercellen kunnen elimineren.
Ten slotte ontwikkelde het team een veelzijdige LM-immuunnanostimulator voor kankertherapie. Om dit te doen, voegden ze anti-geprogrammeerd doodligand-1-antilichaam (Anti-PD-L1), een van de meest veelbelovende immuuncontrolepuntremmers, toe aan het bestaande fluorescerende LM-nanodeeltje. Het gemodificeerde deeltje, Anti-PD-L1‒PEG–ICG–IMIQ–LM, werd efficiënt verspreid met significante fluorescentie. Naarmate de tijd na de bestraling langer werd, nam de oppervlaktetemperatuur van de tumor lineair toe, wat wijst op het antitumoreffect van het nanodeeltje.
Toevoeging van Anti-PD-L1 aan het nanodeeltje maakte binding van het LM-deeltje aan PD-L1 op de kankercellen mogelijk, waardoor ze werden gemarkeerd voor fagocytose door macrofagen en dendritische cellen (DC). Door laser geïnduceerde Anti-PD-L1–PEG–IMIQ–LM-deeltjes vertoonden de hoogste en volledige verwijdering van kanker, samen met snellere genezing en herstel.
Bovendien vertoonden muizen die werden behandeld met lasergeïnduceerde Anti-PD-L1-PEG-IMIQ-LM-deeltjes, toen de tumor terugkeerde, aanhoudende antitumoreffectiviteit en verlengde overleving.
Terwijl hij de toekomstige implicaties van de studie bespreekt, zegt Dr. Miyako:"Wij geloven dat deze synergetische immunologische effecten en optische nanofuncties van LM's brede therapeutische toepassingen hebben en zouden kunnen bijdragen aan innovatieve theranostische technologieën voor kanker. We hebben goede hoop dat deze technologie beschikbaar zal zijn voor klinische proeven over 10 jaar."
Meer informatie: Yun Qi et al., Door licht activeerbare vloeibare metaalimmunostimulanten voor nanotheranostiek bij kanker, Geavanceerde functionele materialen (2023). DOI:10.1002/adfm.202305886
Journaalinformatie: Geavanceerde functionele materialen
Aangeboden door het Japan Advanced Institute of Science and Technology
 Onderzoeksteam ontdekt hoe antibioticaresistente superbacteriën kunnen worden gesaboteerd
Onderzoeksteam ontdekt hoe antibioticaresistente superbacteriën kunnen worden gesaboteerd  Video:Hoe effectief zijn stoffen maskers tegen het coronavirus?
Video:Hoe effectief zijn stoffen maskers tegen het coronavirus? Snelle en efficiënte scheiding van olie en water bereikt door nieuw ontwikkelde deeltjes
Snelle en efficiënte scheiding van olie en water bereikt door nieuw ontwikkelde deeltjes PowerPoint en LED-projector maken nieuwe techniek mogelijk voor zelfvouwende origami
PowerPoint en LED-projector maken nieuwe techniek mogelijk voor zelfvouwende origami Elektrokatalysatoren voor waterstofproductie onttronen met goedkoop alternatief materiaal
Elektrokatalysatoren voor waterstofproductie onttronen met goedkoop alternatief materiaal
Hoofdlijnen
- Gemuteerd kikkergen stoot roofdieren af
- Een dodelijke schimmel die het witte-neussyndroom veroorzaakt, kan een achilleshiel hebben, studie onthult
- Oncogene: wat is het? & Hoe beïnvloedt het de celcyclus?
- S-fase: wat gebeurt er tijdens deze subfase van de celcyclus?
- Coyotes zijn hier om te verblijven in Noord-Amerikaanse steden. Hoe je ze van een afstand kunt waarderen
- Welke organen helpen het menselijk lichaam om zich te ontdoen van door cellen geproduceerd afval?
- Landbouwgroepen dagen waarschuwing onkruidverdelger in Californië uit
- Hoe werken vaccins met het immuunsysteem?
- Overeenkomsten & verschillen tussen osmose en diffusie
- Röntgenstralen onthullen opname van nanodeeltjes door sojabonen

- Wetenschappers beschrijven een mogelijk ziekteverwekkend mechanisme bij hypertrofische cardiomyopathie
- Nieuw systeem versnelt screening van nanodeeltjes die medicijnen afleveren

- Onderzoekers ontwerpen slimme oppervlakken om alles af te weren, behalve gerichte gunstige uitzonderingen

- Een nieuwe stralingsdetector gemaakt van grafeen

 In klassieke en kwantumveilige communicatie is praktische willekeur onvolledig
In klassieke en kwantumveilige communicatie is praktische willekeur onvolledig China viert voltooiing van rivaliserend satellietnavigatiesysteem
China viert voltooiing van rivaliserend satellietnavigatiesysteem Maleisië bedreigt taxibedrijf Grab met boete van $ 21 miljoen
Maleisië bedreigt taxibedrijf Grab met boete van $ 21 miljoen Namen van de Enzymen in de Mond & Esophagus
Namen van de Enzymen in de Mond & Esophagus  Voorbij goede vibraties:nieuwe inzichten in metamateriële magie
Voorbij goede vibraties:nieuwe inzichten in metamateriële magie De ogen hebben het:wetenschappers 3D-printen menselijke hoornvliezen
De ogen hebben het:wetenschappers 3D-printen menselijke hoornvliezen  Unieke nanocapsules beloven de gerichte medicijnafgifte
Unieke nanocapsules beloven de gerichte medicijnafgifte Start-up ontwikkelt speciale lens voor 3D fotografie en film
Start-up ontwikkelt speciale lens voor 3D fotografie en film
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

