
Wetenschap
Een nieuwe manier om hersenkanker op nanoschaalniveau te visualiseren
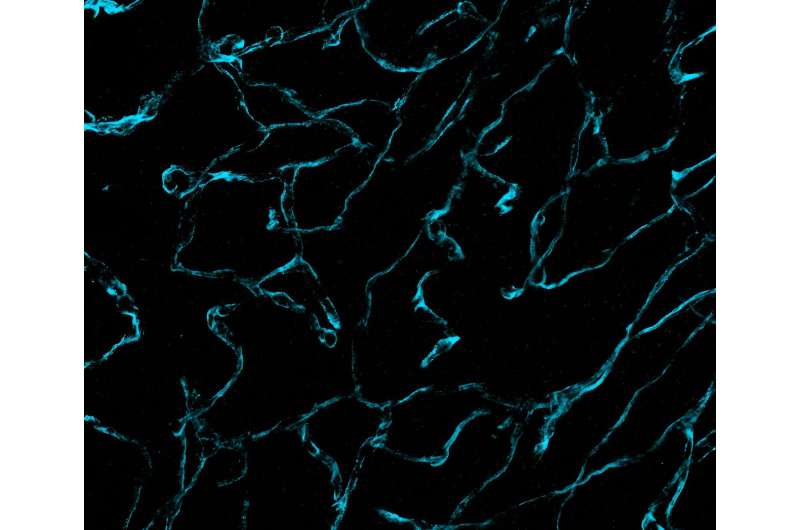
Onderzoekers van het Brigham and Women's Hospital en het Massachusetts Institute of Technology (MIT) hebben ongekend gedetailleerde beelden van hersenkankerweefsel onthuld door gebruik te maken van een nieuwe microscopietechnologie genaamd decrowding expansion pathology (dExPath). Hun bevindingen, gepubliceerd in Science Translational Geneeskunde bieden nieuwe inzichten in de ontwikkeling van hersenkanker, met mogelijke implicaties voor het bevorderen van de diagnose en behandeling van agressieve neurologische ziekten.
"In het verleden hebben we vertrouwd op dure microscopen met superresolutie die alleen zeer goed gefinancierde laboratoria zich konden veroorloven, waarvoor gespecialiseerde training nodig was, en die vaak onpraktisch zijn voor analyses met hoge doorvoer van hersenweefsel op moleculair niveau", zegt hij. Pablo Valdes, MD, Ph.D., alumnus neurochirurgie aan de Brigham en hoofdauteur van het onderzoek. "Deze technologie brengt betrouwbare beeldvorming met superresolutie naar de kliniek, waardoor wetenschappers neurologische ziekten op een nooit eerder bereikt niveau op nanoschaal kunnen bestuderen op conventionele klinische monsters met conventionele microscopen."
Onderzoekers vertrouwden voorheen op dure microscopen met superhoge resolutie om structuren op nanoschaal in cellen en hersenweefsel in beeld te brengen, en zelfs met de meest geavanceerde technologie hadden ze vaak moeite om deze structuren effectief op nanoschaal vast te leggen.
Ed Boyden, Ph.D., de Y. Eva Tan hoogleraar neurotechnologie aan het MIT en co-senior auteur van deze studie, begon dit probleem aan te pakken door weefsels te labelen en ze vervolgens chemisch te modificeren om uniforme fysieke expansie van weefsels mogelijk te maken. Deze expansietechnologie was echter verre van perfect. Wetenschappers vertrouwden op enzymen die bekend staan als proteasen om weefsel af te breken en ontdekten dat deze chemische behandeling met enzymen eiwitten vernietigde voordat ze deze konden analyseren, waardoor alleen een skelet van de oorspronkelijke structuur achterbleef en alleen de labels overbleven.
Boyden en E. Antonio Chiocca, MD, Ph.D., voorzitter Neurochirurgie bij Brigham and Women's Hospital en co-senior auteur van deze studie, begeleidden Valdes tijdens zijn opleiding tot neurochirurg-wetenschapper, om nieuwe chemie te ontwikkelen met dExPath om de beperkingen van de oorspronkelijke uitbreidingstechnologie aan te pakken.
Hun nieuwe technologie modificeert weefsels chemisch door ze in een gel in te bedden en de weefsels te ‘verzachten’ met een speciale chemische behandeling die eiwitstructuren scheidt zonder ze te vernietigen en waardoor weefsels kunnen uitzetten. Dit leverde opwindende bevindingen op voor de onderzoekers van MIT en Brigham, die routinematig commercieel verkrijgbare antilichamen gebruiken om zich te binden aan biomarkers in een monster en deze te verlichten.
Antilichamen zijn echter groot en kunnen vaak niet gemakkelijk celstructuren binnendringen om hun doel te bereiken. Door eiwitten uit elkaar te trekken met dExPath kunnen dezelfde antilichamen die voor kleuring worden gebruikt ruimtes binnendringen om eiwitten in weefsel te binden die vóór de expansie niet toegankelijk waren, waardoor structuren van nanometerformaat of zelfs celpopulaties worden benadrukt die voorheen verborgen waren.
‘Het menselijk brein beschikt over verschillende beveiligingen om zichzelf te beschermen tegen ziekteverwekkers en gifstoffen uit de omgeving. Maar deze elementen maken het bestuderen van hersenactiviteit een uitdaging. Het lijkt een beetje op autorijden door modder en sloten. We hebben geen toegang tot bepaalde celstructuren in de hersenen. hersenen vanwege barrières die in de weg staan”, zegt E. Antonio Chiocca, MD, Ph.D., voorzitter van de afdeling Neurochirurgie aan de Brigham. "Dat is slechts een van de redenen waarom deze nieuwe technologie de praktijk zo zou kunnen veranderen. Als we gedetailleerdere en nauwkeurigere beelden van hersenweefsel kunnen maken, kunnen we meer biomarkers identificeren en beter uitgerust zijn om agressieve hersenziekten te diagnosticeren en te behandelen."
Om de effectiviteit van dExPath te valideren, heeft het team van Boyden en Chiocca de technologie toegepast op gezond menselijk hersenweefsel, hoog- en laaggradig hersenkankerweefsel en hersenweefsel dat is aangetast door neurodegeneratieve ziekten, waaronder de ziekten van Alzheimer en Parkinson. Onderzoekers kleurden weefsel op hersen- en ziektespecifieke biomarkers en maakten beelden voor en na het uitbreiden van monsters met dExPath.
De resultaten onthulden een uniforme en consistente expansie van het weefsel zonder vervorming, waardoor nauwkeurige analyse van eiwitstructuren mogelijk werd. Bovendien elimineerde dExPath effectief fluorescerende signalen in hersenweefsel genaamd lipofuscine, wat beeldvorming van subcellulaire structuren in hersenweefsels erg moeilijk maakt, waardoor de beeldkwaliteit verder wordt verbeterd. Verder zorgde dExPath voor sterkere fluorescentiesignalen voor verbeterde labeling en gelijktijdige labeling van maximaal 16 biomarkers in hetzelfde weefselspecimen. Met name bleek uit dExPath-beeldvorming dat tumoren die eerder als 'laaggradig' waren geclassificeerd, agressievere kenmerken en celpopulaties vertoonden, wat erop wijst dat de tumor veel gevaarlijker zou kunnen worden dan verwacht.
Hoewel veelbelovend, vereist dExPath validatie op grotere steekproefomvang voordat het kan bijdragen aan de diagnose van neurologische aandoeningen zoals hersenkanker. Valdes onderstreept dat zijn team, hoewel nog in de beginfase, ernaar streeft dat deze technologie uiteindelijk als diagnostisch hulpmiddel kan dienen en uiteindelijk de patiëntresultaten kan verbeteren.
"We hopen dat we met deze technologie op nanoschaalniveau de ingewikkelde werking van hersentumoren en hun interacties met het zenuwstelsel beter kunnen begrijpen, zonder afhankelijk te zijn van exorbitant dure laboratoriumapparatuur", zegt Valdes, die nu assistent-professor neurochirurgie is en Jennie. Sealy Distinguished Chair in Neuroscience aan de medische afdeling van de Universiteit van Texas.
“De toegankelijkheid van dExPath zal beeldvorming met superresolutie mogelijk maken om de biologische verwerking op nanometerniveau in menselijk weefsel in de neuro-oncologie en bij neurologische ziekten zoals de ziekte van Alzheimer en Parkinson te begrijpen, en op een dag zelfs diagnostische strategieën en patiëntresultaten kunnen verbeteren. "
Auteurs zijn Pablo Valdes (BWH en MIT), Chih-Chieh (Jay) Yu, Jenna Aronson, Debarati Ghosh, Yongxin Zhao, Bobae An (MIT), Joshua D. Bernstock (BWH en MIT), Deepak Bhere (BWH), Michelle M. Felicella, Mariano S. Viapiano, Khalid Shah (BWH), en co-corresponderende senior auteurs E. Antonio Chiocca en Edward S. Boyden.
Meer informatie: Pablo Valdes et al., Verbeterde immuunkleuring van nanostructuren en cellen in monsters van menselijke hersenen door middel van door expansie gemedieerde ontbevolking van eiwitten, Science Translational Medicine (2024). DOI:10.1126/scitranslmed.abo0049
Journaalinformatie: Wetenschappelijk translationele geneeskunde
Aangeboden door Brigham and Women's Hospital
 De kracht van honing door zijn eiwitten begrijpen
De kracht van honing door zijn eiwitten begrijpen Nieuw mechanisme voor het reguleren van de aanvoer van DNA-bouwstenen voor betere antibiotica
Nieuw mechanisme voor het reguleren van de aanvoer van DNA-bouwstenen voor betere antibiotica Pool Chloorsterkte in vergelijking met Huishoudbleek
Pool Chloorsterkte in vergelijking met Huishoudbleek  Hoe suikerminnende microben toekomstige auto's van stroom kunnen voorzien
Hoe suikerminnende microben toekomstige auto's van stroom kunnen voorzien Veel oude boeken bevatten giftige chemicaliën – zo kun je ze herkennen
Veel oude boeken bevatten giftige chemicaliën – zo kun je ze herkennen
 Stadia van de ontwikkeling van kakkerlakken
Stadia van de ontwikkeling van kakkerlakken Een op bliksem gebaseerde nowcast-waarschuwingsaanpak om kortdurende regenval te voorspellen
Een op bliksem gebaseerde nowcast-waarschuwingsaanpak om kortdurende regenval te voorspellen Opwarming van de aarde kan El Niño-gebeurtenissen minder voorspelbaar maken
Opwarming van de aarde kan El Niño-gebeurtenissen minder voorspelbaar maken De winter is een belangrijke motor voor de uitstoot van lachgas uit boreale meren
De winter is een belangrijke motor voor de uitstoot van lachgas uit boreale meren Het verschil tussen boomsap en boomhars
Het verschil tussen boomsap en boomhars
Hoofdlijnen
- Enzymen: wat is het? & Hoe werkt het?
- Zwarte geit gaat weer gedijen in Israël
- Oorlog tegen onkruid eist zijn tol van nuttige bacteriën in de bodem
- Huilende olifanten en giechelende ratten - dieren hebben gevoelens, te
- Orka's ademen slechts één keer tussen de duiken door, bevestigt onderzoek
- Leven in drijfhout in zee:het geval van drijfhoutspecialist talitrids
- Hoe veehouders in Brazilië omgaan met weersschokken
- Wat is histonacetylatie?
- Laat in video's de ivoorsnavelspecht zien, of is deze uitgestorven?
- Triple-mode transistors tonen potentieel:onderzoekers introduceren op grafeen gebaseerde versterkers
- Nanodeeltjes vastlopen op de water-olie-interface

- Defecten zijn perfect in lasergeïnduceerd grafeen
- Nanogestructureerde tingassensoren kunnen de wereld helpen de klimaatcrisis aan te pakken

- Team ontwikkelt nieuw oppervlaktedesign geïnspireerd op slangenhuid

 Hoe weeg je een enkel molecuul?
Hoe weeg je een enkel molecuul? NASA ziet het einde van ex-tropische cycloon 02W
NASA ziet het einde van ex-tropische cycloon 02W De voedselketen van zoutwatervissen
De voedselketen van zoutwatervissen Gemagnetiseerde gasstromen voeden een jonge sterrenhoop
Gemagnetiseerde gasstromen voeden een jonge sterrenhoop Effect van menselijke activiteiten op het milieu
Effect van menselijke activiteiten op het milieu  Eerste resultaten van de Dark Energy Survey
Eerste resultaten van de Dark Energy Survey Innovatieve opto-elektronische componenten met fosfor
Innovatieve opto-elektronische componenten met fosfor  Topologie wordt magnetisch:de nieuwe golf van topologische magnetische materialen
Topologie wordt magnetisch:de nieuwe golf van topologische magnetische materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

