
Wetenschap
Nieuw mechanisme voor het reguleren van de aanvoer van DNA-bouwstenen voor betere antibiotica
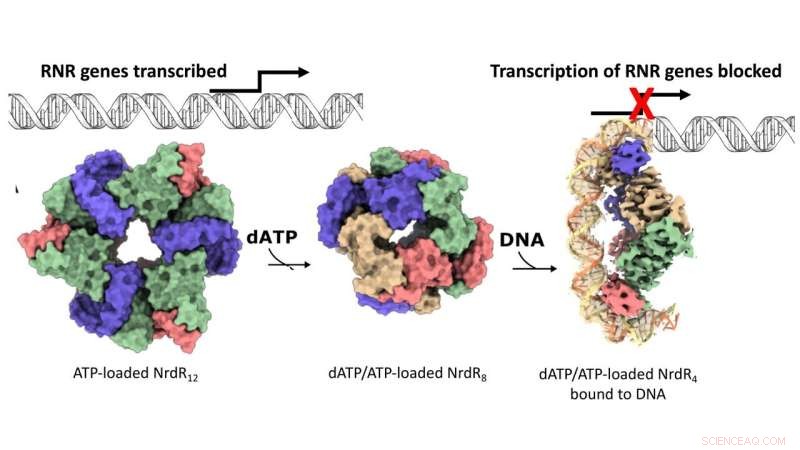
Het werkingsmechanisme van de RNR-specifieke repressor NrdR. Oppervlakteweergave van de cryo-EM-kaarten voor de dodecamere, octamere en DNA-gebonden tetramere NrdR-structuren. NrdR-monomeren in elke tetrameersamenstelling zijn beige, blauw, groen en roze gekleurd. DNA wordt schematisch weergegeven, behalve het deel opgelost door cryo-EM waar de twee antiparallelle DNA-strengen respectievelijk oranje en lichtgeel zijn. Krediet:Inna Rozman Grinberg
In een nieuwe studie gepubliceerd in Nature Communications , laten onderzoekers van de Universiteit van Stockholm voor het eerst zien hoe NrdR zich bindt aan DNA om RNR te remmen. Het nieuwe mechanisme zou wetenschappers kunnen helpen betere antibiotica te ontwerpen door zich te richten op het vermogen van een ziekteverwekker om zich voort te planten.
"We hebben NrdR meer dan tien jaar geleden ontdekt, maar de manier waarop het werkt was een raadsel. In dit artikel hebben we biochemische en structurele studies gecombineerd om erachter te komen hoe NrdR aan DNA bindt", zegt Inna Rozman Grinberg, onderzoeker bij de afdeling Biochemie en Biofysica aan de Universiteit van Stockholm en hoofdauteur van de studie.
DNA-synthese is het proces van het creëren van nieuwe DNA-moleculen dat plaatsvindt wanneer een cel zich deelt. In vrijwel alle levende organismen levert het enzym ribonucleotidereductase (RNR) bouwstenen voor de nieuwe DNA-strengen. Bij veel bacteriën, waaronder bekende pathogenen zoals Mycobacterium tuberculosis, wordt de synthese van RNR uitgeschakeld door het repressoreiwit NrdR. Het mechanisme dat ten grondslag ligt aan het samenspel tussen RNR en NrdR bleef echter ongrijpbaar. Wanneer bacteriële cellen zich delen, wordt RNR in het algemeen geactiveerd om bouwstenen te leveren voor het maken van nieuw DNA. In de tussentijd blijft NrdR uitgeschakeld. Wanneer de DNA-synthese is voltooid, bindt NrdR aan DNA, waardoor verdere synthese van RNR wordt voorkomen.
Maar hoe voelen cellen wanneer het tijd is om RNR uit te schakelen? Het antwoord ligt in de relatieve concentratieverhouding tussen twee sleutelmoleculen, namelijk adenosinetrifosfaat (ATP) en deoxyadenosinetrifosfaat (dATP). De onderzoekers toonden aan dat sommige RNR's zichzelf kunnen uitschakelen bij hoge dATP-niveaus. NrdR daarentegen bindt alleen aan DNA en remt de synthese van RNR wanneer de dATP-niveaus hoog zijn. Dit detectiemechanisme, dat bijna uitsluitend wordt gebruikt door RNR en NrdR, wordt gemedieerd via een eiwitdomein dat "ATP-kegel" wordt genoemd.
"Dit mechanisme benadrukt een opwindend aspect van eiwitevolutie", zegt Inna Rozman Grinberg.
Volgens Inna Rozman Grinberg, aangezien NrdR overvloedig aanwezig is in bacteriën maar afwezig is bij mensen, zou de ATP-kegel kunnen worden gebruikt als een antibioticumdoelwit tegen pathogenen met een enkele RNR, of tegen pathogenen met NrdR om al hun RNR's te beheersen. "Voor zover wij weten, is dit het enige voorbeeld van een evolutionair mobiel eiwitdomein dat zowel de expressie als de activiteit van een enzym regelt." + Verder verkennen
RNR 'switch' biedt hoop in strijd tegen antibioticaresistente bacteriën
 Ongebruikelijk halfmetaal vertoont bewijs van unieke toestanden van oppervlaktegeleiding
Ongebruikelijk halfmetaal vertoont bewijs van unieke toestanden van oppervlaktegeleiding Nieuwe 3D-röntgentechniek onthult geheimen van binnenuit botten
Nieuwe 3D-röntgentechniek onthult geheimen van binnenuit botten Ongebruikelijke kobaltverbinding ontwikkeld voor dunnefilmproductie
Ongebruikelijke kobaltverbinding ontwikkeld voor dunnefilmproductie Nieuwe krachtige analogen van plantenhormoon zorgen voor verlichting van droogtestress voor gewassen
Nieuwe krachtige analogen van plantenhormoon zorgen voor verlichting van droogtestress voor gewassen Opkomst van chiraliteit en structurele complexiteit in eenkristallen op moleculair en morfologisch niveau
Opkomst van chiraliteit en structurele complexiteit in eenkristallen op moleculair en morfologisch niveau
 Tyfoons en mariene eutrofiëring zijn waarschijnlijk de ontbrekende bron van organische stikstof in ecosystemen
Tyfoons en mariene eutrofiëring zijn waarschijnlijk de ontbrekende bron van organische stikstof in ecosystemen Wat zijn de 3 delen van de biosfeer?
Wat zijn de 3 delen van de biosfeer?  Brekende golven stuwen oude moleculen de lucht in
Brekende golven stuwen oude moleculen de lucht in Het diepe verleden van de Noordelijke IJszee biedt aanwijzingen voor de nabije toekomst
Het diepe verleden van de Noordelijke IJszee biedt aanwijzingen voor de nabije toekomst Water stroomt over Antarctica:uit nieuw onderzoek blijkt dat vloeistofstroom wijdverspreider is dan gedacht
Water stroomt over Antarctica:uit nieuw onderzoek blijkt dat vloeistofstroom wijdverspreider is dan gedacht
Hoofdlijnen
- Is de remedie tegen kanker een virus?
- Karkas van Noord-Atlantische rechtse walvis gespot in Massachusetts
- Individuele genomen van patiënten kunnen de werkzaamheid beïnvloeden, veiligheid van het bewerken van genen
- Hoe werkt ATP?
- Onderzoekers bestuderen het suikeropnamemechanisme van industrieel micro-organisme
- Lantaarnvissen onthullen hoe de opwarming van de oceaan de schemerzone beïnvloedt
- Eerste Amerikaanse vrouw bevalt van getransplanteerde baarmoeder
- Hoe nauwkeurig is ons mentale beeld van onszelf?
- Wat doet de temporale kwab?
- Studie benadrukt belofte van galliumoxiden voor stralingsdetectoren van de volgende generatie

- Nieuw synthetisch protocol om een 3D poreus organisch netwerk te vormen

- Boornitride vernietigt voor altijd chemicaliën PFOA, GenX
- Onderzoekers deconstrueren oud Joods perkament met behulp van meerdere beeldvormingstechnieken
- Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen

 Oslo wil zijn uitstoot tegen 2030 met 95 procent verminderen
Oslo wil zijn uitstoot tegen 2030 met 95 procent verminderen Als een daad van zelfonthulling, creativiteit op de werkplek kan een riskante onderneming zijn
Als een daad van zelfonthulling, creativiteit op de werkplek kan een riskante onderneming zijn Catastrofale zeespiegelstijging door het smelten van Antarctica mogelijk met ernstige opwarming van de aarde
Catastrofale zeespiegelstijging door het smelten van Antarctica mogelijk met ernstige opwarming van de aarde NTSB:Tesla Autopilot, afgeleide bestuurder veroorzaakt dodelijke crash (update)
NTSB:Tesla Autopilot, afgeleide bestuurder veroorzaakt dodelijke crash (update) Afbeelding:Dorian brengt vernietiging
Afbeelding:Dorian brengt vernietiging Op de verjaardag van Katrina, New Orleans zet zich schrap voor Harvey
Op de verjaardag van Katrina, New Orleans zet zich schrap voor Harvey Commentaar:COVID-19 verergerde de problemen van de Engelse pubindustrie
Commentaar:COVID-19 verergerde de problemen van de Engelse pubindustrie NASA-missie probeert heldere, nachtelijke wolken te begrijpen door er een te creëren
NASA-missie probeert heldere, nachtelijke wolken te begrijpen door er een te creëren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

