
Wetenschap
Evaluatie van on- en off-target effecten van zelf-geassembleerd EGFR siRNA-afgiftesysteem
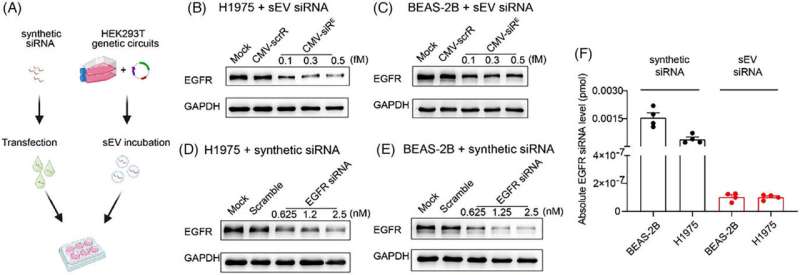
In een studie gepubliceerd in de Clinical and Translational Medicine evalueerde een onderzoeksgroep van de Universiteit van Nanjing de on- en off-target effecten van een zelf-geassembleerd siRNA-afgiftesysteem.
RNA-interferentie (RNAi)-therapie omvat de afgifte van klein interfererend RNA (siRNA) aan doelcellen om therapeutische effecten teweeg te brengen. Hoewel siRNA een specifieke binding aan het doelgen vertoont voor on-target-effecten, kan het ook interageren met niet-target-genen, wat resulteert in off-target-effecten. Een van de belangrijkste uitdagingen bij RNAi-therapie ligt dus in het bereiken van een evenwicht tussen on-target- en off-target-effecten om de gewenste on-target-impact te vergroten en tegelijkertijd het bijbehorende off-target-risico te minimaliseren.
De onderzoeksgroep van de Universiteit van Nanjing, bestaande uit Chen-Yu Zhang en Xi Chen, ontwikkelde een unieke aanpak voor de levering van siRNA door de gastheerlever te herprogrammeren om zelfassemblerende siRNA's te synthetiseren, ingekapseld in kleine extracellulaire blaasjes (sEV's) voor levering aan specifieke weefsels om verschillende ziekten te behandelen.
In deze studie onderzochten de auteurs verder de on- en off-target effecten van het zelf-geassembleerde siRNA-afgiftesysteem, waarbij ze de uitdagingen van in vivo siRNA-afgifte aanpakken en het therapeutische potentieel en de bioveiligheid ervan benadrukken. Ze benadrukten de superieure potentie van de zelf-geassembleerde siRNA's bij het uitschakelen van specifieke doelwitten vergeleken met synthetische siRNA's.
Transcriptomische analyse bevestigde verder minimale off-target-effecten in normale weefsels en significante anti-EGFR-effecten in tumorcellen in vivo. Over het geheel genomen biedt de studie veelbelovende inzichten in de therapeutische werkzaamheid en bijwerkingen van het in vivo zelf-geassembleerde siRNA-toedieningssysteem.
Betekenis van de bevindingen
Deze studie heeft de indrukwekkende werkzaamheid onthuld van zelf-geassembleerd, in sEV ingekapseld siRNA, dat krachtige interferentie vertoonde op het EGFR-eiwit met slechts 1/2.000.000 van de synthetische transfectiehoeveelheid. Deze onthulling geeft aan dat de endogeen verwerkte, in sEV ingekapselde siRNA's naadloos functioneren in ontvangende cellen op fysiologische niveaus, terwijl de accumulatie van suprafysiologische niveaus van synthetische siRNA's in normale cellen cytotoxiciteit kan veroorzaken.
Daarom is de in vivo zelf-geassembleerde siRNA-toedieningsstrategie niet alleen effectief bij een vrij lage siRNA-concentratie in tumorcellen, maar vertoont deze ook een betere bioveiligheid voor somatische cellen dan synthetische siRNA's.
De off-target-activiteit van siRNA's kan leiden tot onvoorziene fenotypes en de therapeutische voordelen van siRNA's in gevaar brengen. In deze studie zijn de off-target risico's van in vivo zelf-geassembleerde EGFR-siRNA's nauwgezet beoordeeld door middel van transcriptomische sequencing.
In normale weefsels werd geen statistisch significante verrijking voor perfecte overeenkomsten tussen het EGFR-siRNA-zaadgebied en 3'-UTR's van gedownreguleerde transcripten waargenomen. In tumorweefsel onthulde genontologie (GO)-verrijkingsanalyse dat de meeste van de belangrijkste GO-termen nauw verband hielden met EGFR-signalering. Uit de gegevens blijkt dat de off-target effecten in normale weefsels minimaal zijn vergeleken met de on-target effecten die worden waargenomen in tumorcellen.
Wat betreft de potentiële risico's die gepaard gaan met verzadiging van de endogene miRNA-machinerie door exogene siRNA's, onthulde analyse van miR-122-doelgenen na in vivo zelf-geassembleerde siRNA-behandeling slechts 13 significante veranderingen onder 1.566 potentiële doelwitten.
De meerderheid van de miR-122-doelen vertoonde vergelijkbare expressiepatronen vergeleken met de onbehandelde groep. Deze gegevens geven aan dat in vivo zelf-geassembleerde EGFR-siRNA's op geschikte fysiologische niveaus aanwezig zijn en weinig kans hebben om hepatotoxiciteit te veroorzaken door verstoringen in de intrinsieke miRNA-routes.
Over het geheel genomen betekent deze studie een nieuwe richting voor RNAi-therapie, met aanzienlijke implicaties voor de klinische adoptie van het in vivo zelfassemblerende siRNA-afgiftesysteem.
In tegenstelling tot conventionele gentherapie vertoont deze methode een hoge specificiteit met minimale off-target risico's en geen toxische bijwerkingen. Bovendien biedt de studie nieuwe inzichten voor het beoordelen van gevestigde en niet-vastgestelde bijwerkingen bij de ontwikkeling van in vivo siRNA-therapie voor diverse genen.
Meer informatie: Hongyuan Guo et al, Evaluatie van on- en off-target effecten van zelf-geassembleerde epidermale groeifactorreceptor, klein interfererend RNA-afgiftesysteem, Klinische en translationele geneeskunde (2024). DOI:10,1002/ctm2,1579
Aangeboden door Nanjing University School of Life Sciences
 Onderzoeker meldt dat de manier waarop sikkelcellen worden gevormd de sleutel kan zijn om ze te stoppen
Onderzoeker meldt dat de manier waarop sikkelcellen worden gevormd de sleutel kan zijn om ze te stoppen Wetenschappers ontwikkelen metaalvrije fotokatalysator om pathogeenrijk water binnen enkele minuten te zuiveren
Wetenschappers ontwikkelen metaalvrije fotokatalysator om pathogeenrijk water binnen enkele minuten te zuiveren Vermindering van het corrosieve effect van gesmolten zouten
Vermindering van het corrosieve effect van gesmolten zouten Hoe kan de pH van invloed zijn op uw vissen?
Hoe kan de pH van invloed zijn op uw vissen?  Moleculaire steigers helpen constructie op nanoschaal
Moleculaire steigers helpen constructie op nanoschaal
 Onderzoeker klimaatverandering komt om bij ongeval in Groenland
Onderzoeker klimaatverandering komt om bij ongeval in Groenland Voorspelling:40% kans dat de aarde binnenkort heter wordt dan het doel van Parijs
Voorspelling:40% kans dat de aarde binnenkort heter wordt dan het doel van Parijs Afvalwaterinjectiesnelheden zijn mogelijk de sleutel geweest tot de grootste aardbeving in Oklahoma's
Afvalwaterinjectiesnelheden zijn mogelijk de sleutel geweest tot de grootste aardbeving in Oklahoma's Ontbrekende schakel in algenfotosynthese gevonden, biedt de mogelijkheid om de gewasopbrengst te verbeteren
Ontbrekende schakel in algenfotosynthese gevonden, biedt de mogelijkheid om de gewasopbrengst te verbeteren Wat zijn de vijf biotische factoren van een aquatisch ecosysteem?
Wat zijn de vijf biotische factoren van een aquatisch ecosysteem?
Hoofdlijnen
- Hoe verbeteren microscopen ons leven vandaag?
- Nieuwe aanpak verdubbelt efficiëntie van stamcelbewerking meer dan, melden onderzoekers
- Tropische bodems zeer gevoelig voor opwarming van de aarde, waarschuwen onderzoekers
- De zeldzaamste slang van Noord-Amerika die meer afbijt dan hij kon kauwen
- Hoe dodelijke parasieten ervoor kiezen mannelijk te zijn:Onderzoekers onthullen genexpressie gedurende de levenscyclus van Cryptosporidium
- Kankerwetenschappers ruiken de genen achter Durians Famous Stink
- DNA-onderzoekers roepen botverzamelaars op om toegang tot botten te delen
- Kan gezichtsblindheid verklaren waarom die persoon op het werk mij nooit gedag zegt?
- Wat irriteert een chimpansee?
- Op zoek naar de beste vorm voor kankerbestrijdende nanodeeltjes
- Onderzoekers ontdekken nanokristallen die door nanobuisjes kunnen persen zonder te veranderen
- Nieuwe elektrodeconfiguratie verbetert de volumetrische prestaties van supercondensatoren
- Team creëert nieuwe technologie voor complexe microstructuren voor gebruik in sensoren, andere apps
- Het visualiseren van intracellulaire nanostructuren van levende cellen met behulp van nanoendoscopie-AFM

 VN ziet 70% kans op El Nino-evenement dit jaar
VN ziet 70% kans op El Nino-evenement dit jaar Het klimaat van de staat China in 2018:meer extreme gebeurtenissen, maar minder verlies
Het klimaat van de staat China in 2018:meer extreme gebeurtenissen, maar minder verlies Onderzoekers vinden zwaartekrachtsgolfkandidaten van binaire fusies van zwarte gaten in openbare LIGO/Maagd-gegevens
Onderzoekers vinden zwaartekrachtsgolfkandidaten van binaire fusies van zwarte gaten in openbare LIGO/Maagd-gegevens Crossover van 2D-metaal naar 3D Dirac-semimetaal in metallic PtTe2-films met lokaal Rashba-effect
Crossover van 2D-metaal naar 3D Dirac-semimetaal in metallic PtTe2-films met lokaal Rashba-effect Herverdeling van rijkdom zou de consumptie kunnen verhogen
Herverdeling van rijkdom zou de consumptie kunnen verhogen Snel, betrouwbare test voor besmetting met micro-organismen
Snel, betrouwbare test voor besmetting met micro-organismen Nieuwe testmethode suggereert dat baby Anzick-1 even oud was als de omliggende Clovis-artefacten
Nieuwe testmethode suggereert dat baby Anzick-1 even oud was als de omliggende Clovis-artefacten Snelheid vinden vanuit massa en hoogte
Snelheid vinden vanuit massa en hoogte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

