
Wetenschap
Een nieuwe aanpak voor het produceren van kunstkraakbeen met behulp van 3D-printen
Is het mogelijk om in het laboratorium weefsel te kweken, bijvoorbeeld ter vervanging van beschadigd kraakbeen? Bij TU Wien (Wenen) is nu een belangrijke stap gezet in de richting van het creëren van vervangend weefsel in het laboratorium – met behulp van een techniek die aanzienlijk verschilt van andere methoden die over de hele wereld worden gebruikt. De studie is gepubliceerd in Acta Biomaterialia .
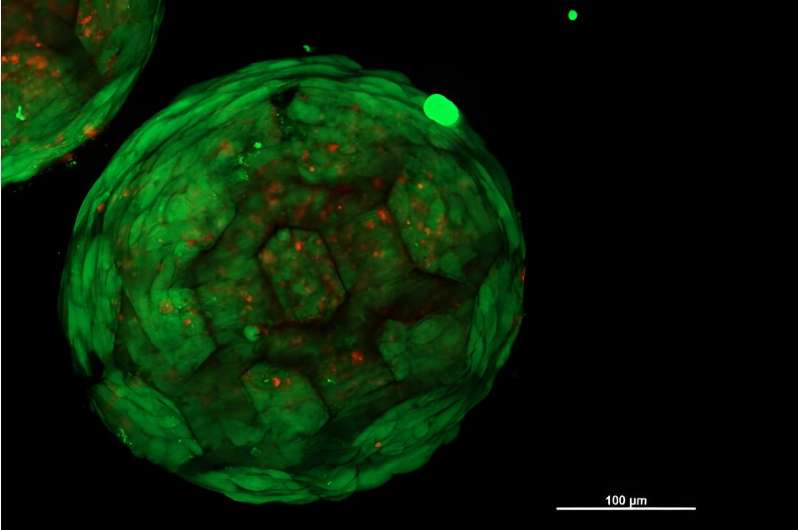
Via een speciaal 3D-printproces met hoge resolutie worden kleine, poreuze bolletjes gemaakt van biocompatibel en afbreekbaar plastic, die vervolgens worden gekoloniseerd met cellen. Deze sferoïden kunnen vervolgens in elke geometrie worden gerangschikt, en de cellen van de verschillende eenheden combineren naadloos om een uniform, levend weefsel te vormen. Kraakbeenweefsel, waarmee het concept nu aan de TU Wien is gedemonstreerd, werd in dit opzicht eerder als bijzonder uitdagend beschouwd.
Kleine bolvormige kooitjes als steiger voor de cellen
"Het kweken van kraakbeencellen uit stamcellen is niet de grootste uitdaging. Het grootste probleem is dat je meestal weinig controle hebt over de vorm van het resulterende weefsel", zegt Oliver Kopinski-Grünwald van het Institute of Materials Science and Technology aan de TU Wien. van de auteurs van de huidige studie. "Dit komt ook door het feit dat dergelijke stamcelklonten in de loop van de tijd van vorm veranderen en vaak krimpen."
Om dit te voorkomen werkt het onderzoeksteam van de TU Wien met een nieuwe aanpak:speciaal ontwikkelde lasergebaseerde 3D-printsystemen met hoge resolutie worden gebruikt om kleine kooiachtige structuren te creëren die op minivoetballen lijken en een diameter hebben van slechts een derde. van een millimeter. Ze dienen als draagstructuur en vormen compacte bouwstenen die vervolgens in elke gewenste vorm kunnen worden samengevoegd.
Stamcellen worden eerst in deze voetbalvormige minikooien gebracht, die het kleine volume snel volledig vullen. "Op deze manier kunnen we op betrouwbare wijze weefselelementen produceren waarin de cellen gelijkmatig verdeeld zijn en de celdichtheid zeer hoog is. Dit zou met eerdere benaderingen niet mogelijk zijn geweest", legt prof. Aleksandr Ovsianikov, hoofd van de afdeling 3D Printing en Biofabrication, uit. onderzoeksgroep aan de TU Wien.

Perfect samen groeien
Het team gebruikte gedifferentieerde stamcellen, d.w.z. stamcellen die zich niet langer kunnen ontwikkelen tot welk type weefsel dan ook, maar waarvan al vooraf is bepaald dat ze een specifiek type weefsel vormen, in dit geval kraakbeenweefsel. Dergelijke cellen zijn vooral interessant voor medische toepassingen, maar de constructie van groter weefsel is een uitdaging als het om kraakbeencellen gaat. In kraakbeenweefsel vormen de cellen een zeer uitgesproken extracellulaire matrix, een gaasachtige structuur tussen de cellen die vaak verhindert dat verschillende celsferoïden op de gewenste manier met elkaar groeien.
Als de 3D-geprinte poreuze sferoïden op de gewenste manier worden gekoloniseerd met cellen, kunnen de sferoïden in elke gewenste vorm worden gerangschikt. De cruciale vraag is nu:combineren de cellen van verschillende sferoïden ook om een uniform, homogeen weefsel te vormen?
"Dit is precies wat we nu voor het eerst hebben kunnen laten zien", zegt Kopinski-Grünwald. "Onder de microscoop kun je heel duidelijk zien:aangrenzende sferoïden groeien samen, de cellen migreren van de ene sferoïde naar de andere en omgekeerd, ze sluiten naadloos op elkaar aan en resulteren in een gesloten structuur zonder holtes - in tegenstelling tot andere methoden die zijn ontwikkeld." tot nu toe gebruikt, waarbij zichtbare grensvlakken blijven tussen aangrenzende celklonten."
De kleine 3D-geprinte steigers geven de algehele structuur mechanische stabiliteit terwijl het weefsel blijft rijpen. Over een periode van een paar maanden worden de plastic structuren afgebroken, ze verdwijnen eenvoudigweg en laten het uiteindelijke weefsel in de gewenste vorm achter.
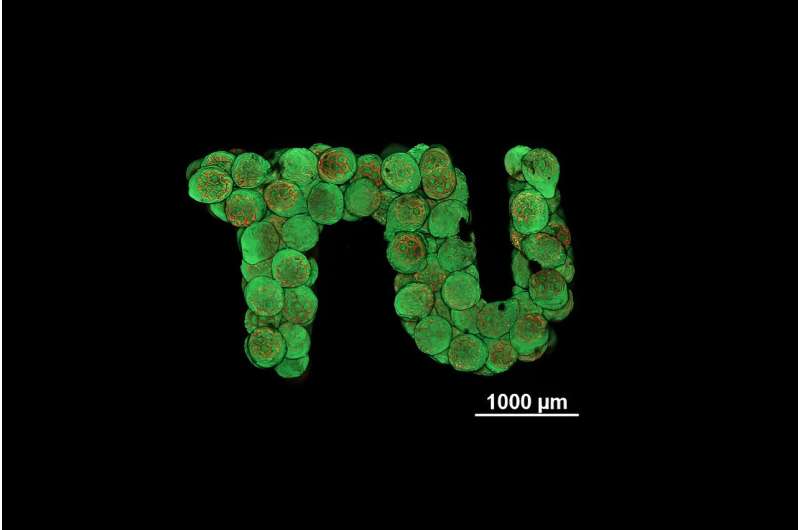
Eerste stap richting medische toepassing
In principe beperkt de nieuwe aanpak zich niet tot kraakbeenweefsel, maar kan deze ook worden gebruikt om verschillende soorten grotere weefsels, zoals botweefsel, op maat te maken. Er moeten echter nog een aantal taken worden opgelost. Anders dan bij kraakbeenweefsel zouden bij deze weefsels boven een bepaalde grootte immers ook bloedvaten moeten worden ingebouwd.
"Een eerste doel zou zijn om kleine, op maat gemaakte stukjes kraakbeenweefsel te produceren die na een blessure in bestaand kraakbeenmateriaal kunnen worden ingebracht", zegt Oliver Kopinski-Grünwald. "In ieder geval hebben we nu kunnen aantonen dat onze methode voor het produceren van kraakbeenweefsel met behulp van bolvormige microscaffolds in principe werkt en beslissende voordelen heeft ten opzichte van andere technologieën."
Meer informatie: Oliver Kopinski-Grünwald et al., Gesteigerde sferoïden als bouwstenen voor bottom-up kraakbeenweefselmanipulatie laten een verbeterde bioassemblagedynamiek zien, Acta Biomaterialia (2023). DOI:10.1016/j.actbio.2023.12.001
Aangeboden door de Technische Universiteit van Wenen
 Wanneer FRETing over kankerbiomarkers niet zal werken, focus in plaats daarvan op knipperen
Wanneer FRETing over kankerbiomarkers niet zal werken, focus in plaats daarvan op knipperen Een kijkje op dun ijs
Een kijkje op dun ijs Reversibele chemo-enzymatische labelstrategie maakt diepgaande analyse van eiwit O-GlcNAcylation mogelijk
Reversibele chemo-enzymatische labelstrategie maakt diepgaande analyse van eiwit O-GlcNAcylation mogelijk Nieuwe nikkelkatalysator werkt in water om broeikasgas om te zetten in chemische grondstof
Nieuwe nikkelkatalysator werkt in water om broeikasgas om te zetten in chemische grondstof Nieuwe eiwitstudie verbreedt kennis van moleculaire basis voor ziekte
Nieuwe eiwitstudie verbreedt kennis van moleculaire basis voor ziekte
 Bezuinigen op het EPA-budget brengt baby's in gevaar - en heeft weinig economische zin
Bezuinigen op het EPA-budget brengt baby's in gevaar - en heeft weinig economische zin Expert bespreekt de waarheid over plastic
Expert bespreekt de waarheid over plastic Verontrustende omvang van plasticvervuiling onthuld
Verontrustende omvang van plasticvervuiling onthuld Plankton is beter bestand tegen voedingsstress dan eerder werd gedacht
Plankton is beter bestand tegen voedingsstress dan eerder werd gedacht Volgens een studie is het waarschijnlijker dat gemeenschappen natuurbehoudsmaatregelen nemen als hun buren dat ook hebben gedaan
Volgens een studie is het waarschijnlijker dat gemeenschappen natuurbehoudsmaatregelen nemen als hun buren dat ook hebben gedaan
Hoofdlijnen
- Ontbrekende schakel in het behoud van soorten:apothekers en scheikundigen kunnen het tij keren wat betreft het uitsterven van planten en dieren
- Wetenschappers winnen de World Food Prize voor hun werk aan de Global Seed Vault
- Waarom gifkikkers zichzelf niet vergiftigen?
- Waarom zijn sommige dieren moeilijker te klonen dan andere?
- Wat zijn de structurele delen van de lange botten in het lichaam?
- Onderzoekers onthullen PI3K-enzymen met dubbele versneller- en remmechanismen
- Wat zit er in je tarwe? Wetenschappers voegen het genoom van de meest voorkomende broodtarwe samen
- Radiologie werpt licht op oude vissoorten coelacanth
- Factoren die van invloed zijn op celverdeling
- Grafeen biedt röntgenfoto-elektronenspectroscopie een kans
- Onderzoekers creëren sub-10 nanometer grafeen nanoribbon patronen

- Driedimensionaal, richtingsafhankelijke krachtmeting op subatomaire schaal

- Nieuw op grafeen gebaseerd meta-oppervlak dat in staat is tot onafhankelijke amplitude- en fasecontrole van licht
- Wetenschappers vinden nanodeeltjes uit die de behandeling van botdefecten kunnen verbeteren
 Computationele astrofysica-team onthult magnetische velden van kosmische gebeurtenissen
Computationele astrofysica-team onthult magnetische velden van kosmische gebeurtenissen Ontdekking van veldgeïnduceerde golftoestand van paardichtheid in supergeleiders bij hoge temperatuur
Ontdekking van veldgeïnduceerde golftoestand van paardichtheid in supergeleiders bij hoge temperatuur Australië moet kernafval onderzoeken voordat het binnenlandse kernenergie probeert
Australië moet kernafval onderzoeken voordat het binnenlandse kernenergie probeert Kinderen meer afgeleid door digitale apparaten in huis, ouders zeggen:
Kinderen meer afgeleid door digitale apparaten in huis, ouders zeggen: Ingenieurs stroomlijnen het ontwerp van straalmotoren
Ingenieurs stroomlijnen het ontwerp van straalmotoren Nieuwe inzichten in de materie van neutronensterren
Nieuwe inzichten in de materie van neutronensterren Gegevens verzameld tijdens orkaan Laura bieden grote voordelen op het gebied van engineering, atmosferische wetenschappelijke velden
Gegevens verzameld tijdens orkaan Laura bieden grote voordelen op het gebied van engineering, atmosferische wetenschappelijke velden Nieuwe methode voor het maken van microdeeltjes kan de ontwikkeling van geneesmiddelen en de productie van nieuwe celstammen versnellen
Nieuwe methode voor het maken van microdeeltjes kan de ontwikkeling van geneesmiddelen en de productie van nieuwe celstammen versnellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

