
Wetenschap
Onderzoekers onthullen PI3K-enzymen met dubbele versneller- en remmechanismen
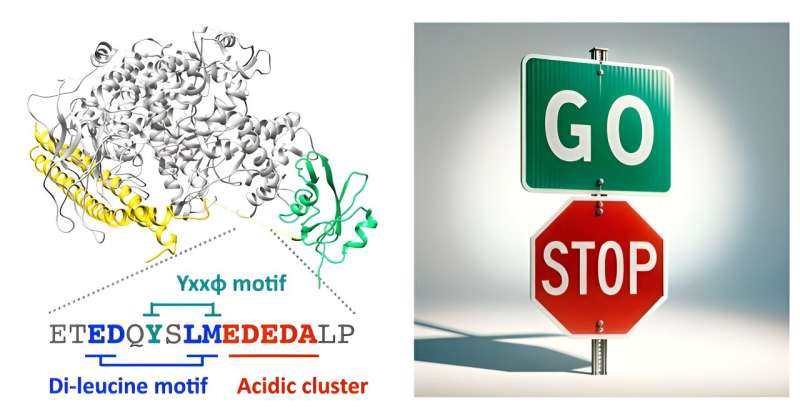
Een groep onderzoekers heeft de conventionele kennis uitgebreid over een cruciaal enzym dat de celmigratie regelt. In een publicatie in het tijdschrift Nature Communications rapporteerden ze dat fosfoinositide 3-kinase (PI3K) niet alleen werkt als een versneller om de celmotiliteit te stimuleren, maar dat het ook een ingebouwd remmechanisme heeft dat migratie belemmert.