
Wetenschap
Beeldvormingstechniek toont nieuwe details van peptidestructuren
Deze kruis-β-fibrillenassemblages zijn ook nuttige bouwstenen binnen designer-biomaterialen voor medische toepassingen, maar hun gelijkenis met hun amyloïde bèta-neven, waarvan de kluwen een symptoom zijn van neurodegeneratieve ziekten, is zorgwekkend. Onderzoekers willen leren hoe verschillende sequenties van deze peptiden verband houden met hun variërende toxiciteit en functie, voor zowel natuurlijk voorkomende peptiden als hun synthetisch gemanipuleerde neven.
Nu kunnen wetenschappers de fibrilassemblages van dichtbij bekijken om te zien dat er opmerkelijke verschillen zijn in de manier waarop synthetische peptiden zich stapelen in vergelijking met amyloïde bèta. Deze resultaten komen voort uit een vruchtbare samenwerking tussen hoofdauteur Matthew Lew, universitair hoofddocent elektrische en systeemtechniek, en Jai Rudra, universitair hoofddocent biomedische technologie, aan de McKelvey School of Engineering van WashU.
"Wij ontwikkelen microscopen om betere metingen op nanoschaal mogelijk te maken, zodat de wetenschap vooruitgang kan boeken", aldus Lew.
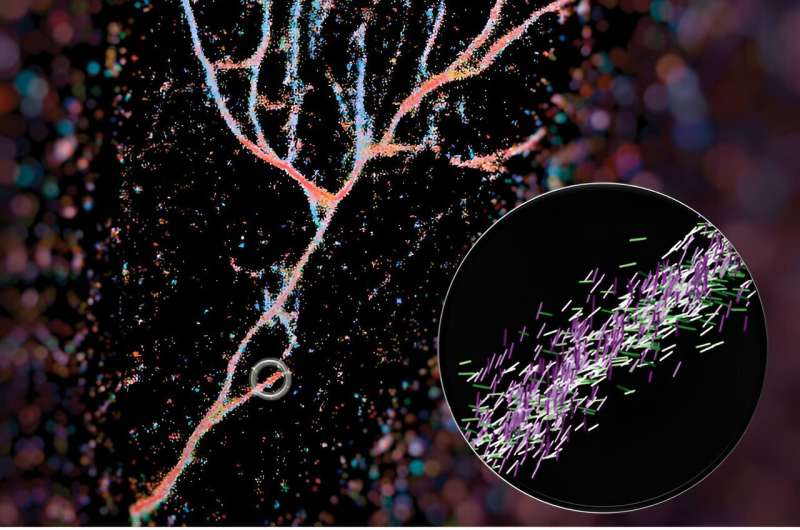
In een artikel dat onlangs is gepubliceerd in ACS Nano Lew en collega's schetsen hoe ze de Nijlrode chemische sonde gebruikten om kruis-β-fibrillen te verlichten. Hun techniek, single-molecule oriëntatie-lokalisatiemicroscopie (SMOLM) genoemd, gebruikt de lichtflitsen van Nijlrood om de vezelstructuren zichtbaar te maken die worden gevormd door synthetische peptiden en door amyloïde bèta.
Het komt erop neer:deze assemblages zijn veel gecompliceerder en heterogener dan verwacht. Dat is goed nieuws, want het betekent dat er meer dan één manier is om eiwitten veilig te stapelen. Met betere metingen en afbeeldingen van fibrilassemblages kunnen bio-ingenieurs de regels beter begrijpen die bepalen hoe eiwitgrammatica de toxiciteit en biologische functie beïnvloedt, wat leidt tot effectievere en minder toxische therapieën.
Ten eerste moeten wetenschappers het verschil tussen beide zien, iets wat zeer uitdagend is vanwege de kleine schaal van deze assemblages.
"De spiraalvormige draaiing van deze vezels is onmogelijk te onderscheiden met een optische microscoop, of zelfs met sommige superresolutiemicroscopen, omdat deze dingen gewoon te klein zijn", aldus Lew.
Dankzij de hoogdimensionale beeldvormingstechnologie die de afgelopen jaren in het laboratorium van Lew is ontwikkeld, kunnen ze de verschillen zien.
Een typische fluorescentiemicroscoop gebruikt fluorescerende moleculen als gloeilampen om bepaalde aspecten van een biologisch doelwit te benadrukken. In het geval van dit werk gebruikten ze een van die sondes, Nijlrood, als sensor voor wat eromheen was. Terwijl Nile Red willekeurig zijn omgeving verkent en in botsing komt met de fibrillen, zendt het lichtflitsen uit die ze kunnen meten om te bepalen waar de fluorescerende sonde zich bevindt en in welke richting deze zich bevindt. Op basis van die gegevens kunnen ze het volledige beeld samenstellen van kunstmatige fibrillen die heel anders stapelen dan natuurlijke fibrillen, zoals amyloïde bèta.
Hun afbeelding van deze fibrilassemblages haalde de cover van ACS Nano en werd samengesteld door eerste auteur Weiyan Zhou, die de afbeelding een kleurcode gaf op basis van waar het Nijlrood naar wees. Het resulterende beeld is een blauwachtig rood stromend geheel van peptiden dat lijkt op een riviervallei.
De onderzoekers zijn van plan technieken zoals SMOLM te blijven ontwikkelen om nieuwe wegen te openen voor het bestuderen van biologische structuren en processen op nanoschaal.
"We zien dingen die je met de bestaande technologie niet kunt zien", zei Lew.