
Wetenschap
Zeer gevoelige nanosensor detecteert subtiele kaliumveranderingen in de hersenen
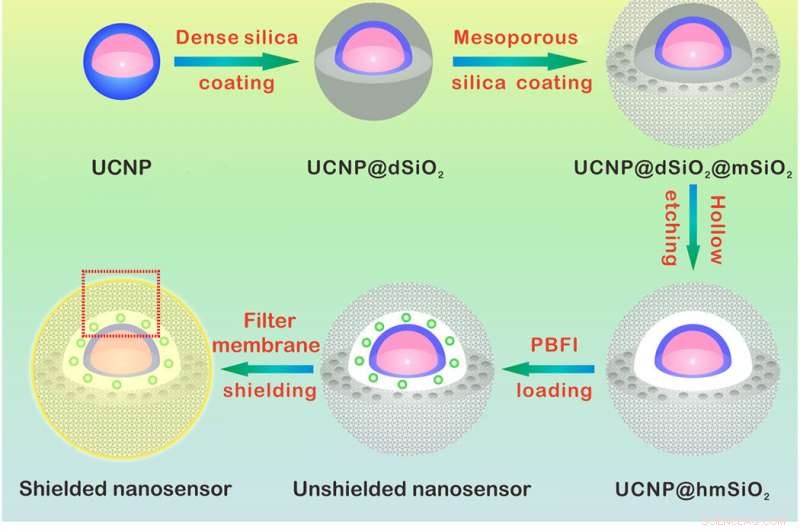
Ontwerp en detectiemechanisme van de K+ nanosensor. (A) Schematische illustratie voor de synthese van de nanosensor. De NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP) kern werd gesynthetiseerd en gecoat met een dichte silicalaag en een opeenvolgende mesoporeuze silicaschil. Het wegetsen van de dichte silicalaag vormt een holle holte die het laden van PBFI mogelijk maakt. De nanosensor werd als laatste gecoat met het K+-selectieve filtermembraan. (B) Schema's met een vergroot beeld van de nanosensor [van het rode gestippelde vak in (A)] en het K + -detectiemechanisme. Door de filtermembraanlaag kan alleen K+ in en uit de nanosensor diffunderen, waardoor de interferentie van andere kationen wordt uitgesloten. Eenmaal verspreid in de nanosensor, K+ zal onmiddellijk aan PBFI binden. Bij NIR-bestraling, het opgeconverteerde UV-licht van de UCNP's wekt PBFI op, wat leidt tot de emissie van K+-gebonden PBFI. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aax9757
Onderzoekers hebben een aantal kaliumionen (K + ) sondes om fluctuerende K . te detecteren + concentraties tijdens verschillende biologische processen. Echter, dergelijke sondes zijn niet gevoelig genoeg om fysiologische fluctuaties bij levende dieren te detecteren en het is niet eenvoudig om diepe weefsels te volgen met excitaties met korte golflengte die tot nu toe in gebruik zijn. In een nieuw rapport Jianan Liu en een team van onderzoekers in de neurowetenschappen, scheikunde, en moleculaire engineering in China, beschrijf een zeer gevoelige en selectieve nanosensor voor nabij-infrarood (NIR) K + ionenbeeldvorming in levende cellen en dieren. Het team construeerde de nanosensor door opconversie-nanodeeltjes (UCNP's) en een commerciële kaliumion-indicator in de holle holte van mesoporeuze silica-nanodeeltjes in te kapselen en ze te coaten met een K + selectief filtermembraan. Het membraan geadsorbeerd K + uit het medium en alle storende kationen weggefilterd. In zijn werkingsmechanisme, UCNP's zetten NIR om in ultraviolet (UV) licht om de kaliumionindicator te prikkelen en fluctuerende kaliumionconcentraties in gekweekte cellen en in diermodellen van ziekten, waaronder muizen en zebravislarven, te detecteren. De resultaten zijn nu gepubliceerd op wetenschappelijke vooruitgang .
Het meest voorkomende intracellulaire kation kalium (K + ) is uiterst cruciaal in een verscheidenheid aan biologische processen, waaronder neurale transmissie, hartslag, spiercontractie en nierfunctie. Variaties in de intracellulaire of extracellulaire K + concentratie (hierin aangeduid als [K + ]) wijzen op abnormale fysiologische functies, waaronder hartstoornissen, kanker, en suikerziekte. Als resultaat, onderzoekers willen graag effectieve strategieën ontwikkelen om de dynamiek van [K + ] schommelingen, specifiek met directe optische beeldvorming.
De meeste bestaande sondes zijn niet gevoelig voor K + detectie onder fysiologische omstandigheden en kan geen onderscheid maken tussen fluctuaties tussen [K + ] en het bijbehorende natriumion ([Na + ]) tijdens transmembraantransport in de Na + /K + pompen. Hoewel fluorescentie-levensduurbeeldvorming K . kan onderscheiden + en Na + in wateroplossing, de methode vereist gespecialiseerde instrumenten. de meeste K + sensoren worden ook geactiveerd met licht van korte golflengte, inclusief ultraviolet (UV) of zichtbaar licht, wat leidt tot aanzienlijke verstrooiing en beperkte penetratiediepte bij het onderzoeken van levende weefsels. In tegenstelling tot, de voorgestelde bijna-infrarood (NIR) beeldvormingstechniek zal unieke voordelen bieden tijdens diepe weefselbeeldvorming als een plausibel alternatief.
Structurele karakterisering van de K+ nanosensor. (A tot C) Ringvormige donkerveldbeelden met hoge hoek van UCNP@dSiO2 (A), UCNP@dSiO2@mSiO2 (B), en UCNP@hmSiO2 (C). (D) Scanning elektronenmicroscopie (SEM) afbeelding van de afgeschermde nanosensor. (E) SEM-beeld van de afgeschermde nanosensor ondergedompeld in een waterige oplossing met 150 mM Na+, 150 mM K+, 2 mM Ca2+, 2 mM Mg2+, 50 M Fe2+, 2 mM Zn2+, 50 M Mn2+, en 50 uM Cu2+. (F) EDS-elementaire lijnscanprofielen langs de witte lijn in (E) onthullen dat alleen K + -signalen aanwezig zijn in de mesoporiën en holle holtes van de afgeschermde nanosensoren. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aax9757 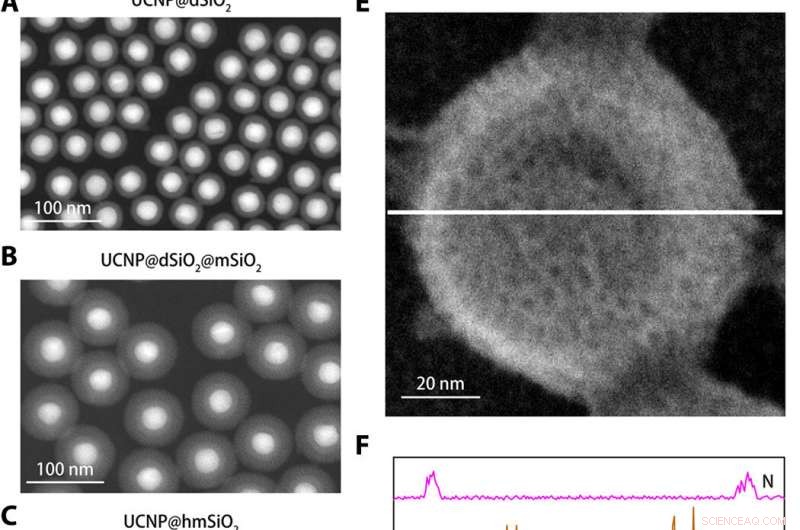
Om de nanosensor te ontwikkelen, Liu et al. ingekapselde upconversion nanodeeltjes (UCNP's) en een commerciële K + indicator-kaliumbindend benzofuraanisoftalaat (PBFI) in de kern van mesoporeuze silica-nanodeeltjes (MSN's). De UCNP's waren in staat om NIR-licht om te zetten in UV-licht en de acceptor van de K . te prikkelen + indicator door middel van luminescentie-resonantie-energieoverdracht. Ze beschermden het buitenoppervlak van silica nanodeeltjes met een dunne laag K + selectief filtermembraan met microporiën gemaakt van carbonylzuurstof voor specificiteit. De opzet was in het voordeel van de gratis overdracht van K + door de membraanporie, terwijl wordt voorkomen dat andere biologisch relevante kationen erdoorheen diffunderen. Dankzij de techniek konden ze kleine fluctuaties in [K + ] in de oplossing. Het team gebruikte transmissie-elektronenmicroscopie (TEM) om de goed gecontroleerde structuur en het uiterlijk van de nanodeeltjes te observeren tijdens elke stap van de constructie van nanosensoren. Dynamische lichtverstrooiing bevestigde de aanwezigheid van een filtermembraan op het oppervlak van de afgeschermde nanosensor.
Beeldvorming van K+ efflux in HEK 293-cellen. (A) Schema's die de detectie van K + efflux tonen door een streptavidine-geconjugeerde nanosensor, die is vastgemaakt aan een met biotine gemodificeerde cel. (B) Confocale microscopiebeelden die de fluorescentie (bij 400 tot 500 nm en 500 tot 600 nm) van nanosensor-gelabelde HEK 293-cellen op verschillende tijdstippen na behandeling met de K + effluxstimulator (een mengsel van 5 μM nigericine, 5 M bumetanide, en 10 uM ouabain). (C) Tijdsverloop van nanosensor fluorescentie variaties en berekende tijdsafhankelijkheid van K+ efflux tarief na behandeling met K+ efflux stimulator. (D) Tijdafhankelijke fluorescentiefluctuaties van afgeschermde nanosensor-gelabelde HEK 293-cellen na behandelingen met verschillende concentraties (20, 40, 60, 80, en 100%) K+ effluxstimulator. Resultaten van vijf onafhankelijke experimenten werden samengevat als gemiddelde ± SEM in (C) en (D). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aax9757 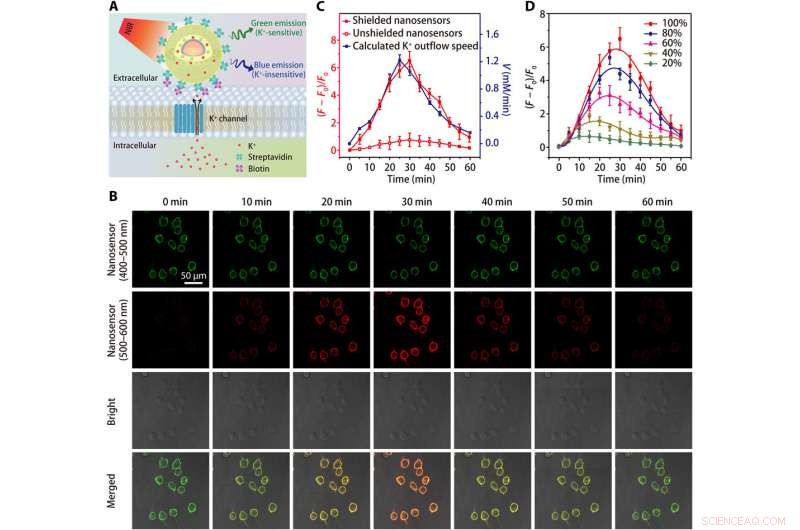
Het team testte de verhoogde gevoeligheid van de afgeschermde nanosensor in een fysiologisch bereik (0 tot 150 mM) en toonde een 12-voudige toename in fluorescentie-intensiteit in vergelijking met niet-afgeschermde nanosensoren. de K + sondes moesten een hoge selectiviteit tegen Na . vertonen + , die Liu et al. geverifieerd met behulp van de afgeschermde nanosensor door snelle detectie van consistente fluorescentiegevoeligheid voor fluctuerende [K + ], terwijl het onaangetast blijft door [Na + ].
Omdat levende cellen afhankelijk zijn van natrium-kaliumadenosinetrifosfatase (Na + /K + pomp) om een steile [K + ] gradiënt over hun plasmamembraan, het proces is gedeeltelijk verantwoordelijk voor het energieverbruik van de cel. Defecten in het cellulaire energiemetabolisme kunnen leiden tot een verlies van de [K + ] verloop, terwijl het aanleiding geeft tot extracellulair [K + ] bekend als [K + ] 0, die de wetenschappers volgden om een waardevolle indicator van de levensvatbaarheid en groei van de cellen te verkrijgen. Daarna, ze verhoogden de specificiteit van de nanosensor om celdood of proliferatiesnelheden te detecteren door polyethyleenglycol (PEG) op het oppervlak van nanosensoren te enten in een kweekmedium dat de menselijke embryonale nier 293-cellijn bevat. Vervolgens optimaliseerden ze het protocol door grote aantallen nanosensoren op celmembranen te verankeren met behulp van streptavidine-geconjugeerde nanosensoren aan biotine-gemodificeerde cellen. De resultaten wezen op een verbeterde gevoeligheid van afgeschermde nanosensoren om de K . continu te bewaken + uitstroom.
K + -beeldvormingsresultaten van de met afgeschermde nanosensoren behandelde muizenhersenen bij het initiëren van verspreidingsdepressie door KCl-triggering. De volledige video is acht keer sneller dan de echte snelheid. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aax9757 
Het team paste vervolgens de afgeschermde nanosensor toe om corticale verspreidingsdepressie (CSD) in de hersenen van muizen te onderzoeken als een golfachtige voortplanting van neurale activiteit. Het proces omvat typisch een langzame verspreiding van K + in het corticale oppervlak en kan in de muizenhersenen worden geactiveerd via incubatie met kaliumchloride (KCl). De wetenschappers volgden tegelijkertijd het lokale veldpotentieel en het optische signaal door het chirurgische craniale venster en observeerden een golf van toenemende [K + ] 0 propageren zich geleidelijk over de cortex na stimulatie. Liu et al. geen golf waargenomen bij muizen die waren geïnjecteerd met niet-afgeschermde nanosensoren, wat het belang aangeeft van het buitenste filter voor een verbeterde gevoeligheid van de nanosensor. De geregistreerde golfsnelheid verschilde niet significant van de waarden die werden verkregen met behulp van bloedzuurstofniveau-afhankelijke magnetische resonantiebeeldvorming (MRI) bij patiënten met migraine-aura.
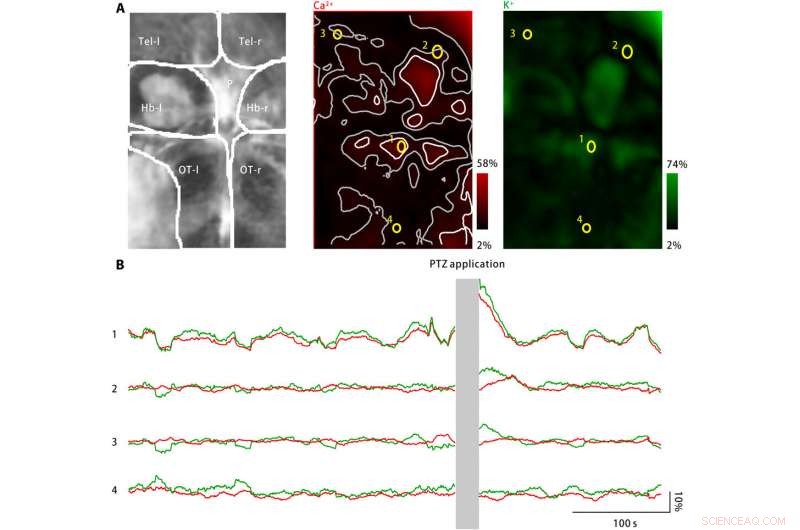
Extracellulair kalium barstte in larvale zebravishersenen na PTZ-behandeling. (A) PTZ-behandeling veroorzaakte verhogingen van zowel de neuronale calciumactiviteit (midden) als de extracellulaire kaliumconcentratie (rechts). Links:afgebeelde hersengebieden omvatten de linker en rechter telencefala (Tel-l en Tel-r, respectievelijk), de linker en rechter habenulae (Hb-l en Hb-r, respectievelijk), de pijnappelklier (P), en de linker en rechter optische tecta (OT-l en OT-r, respectievelijk). Midden:Neuronale calciumactiviteit werd gevolgd met behulp van een genetisch tot expressie gebrachte calciumindicator, jRGECO1a. De gemeten responsamplitude is gecodeerd in rood en terug in kaart gebracht naar het afgebeelde hersengebied. Verspreide activiteitsvlekken zijn gemarkeerd als wit, en hun aangrenzende zones zijn grijs gemarkeerd. Er zijn vier ROI's (geel) geselecteerd. Rechts:Extracellulaire kaliumconcentratie werd gevolgd met behulp van de kalium-nanosensor. De gemeten responsamplitude is groen gecodeerd en terug in kaart gebracht naar het afgebeelde hersengebied. (B) Neuronale calciumactiviteit (rood) en extracellulaire kaliumconcentraties waargenomen voor de vier representatieve ROI's zijn gemarkeerd in (A). Na PTZ-toepassing, zowel de neuronale calciumactiviteit als de extracellulaire kaliumconcentratie zijn verhoogd op verschillende activiteitsplekken, inclusief de pijnappelklier en de voorste optische tecta, zoals weergegeven door ROI1. In aangrenzende zones van de activiteitenplekken, verandering van neuronale calciumactiviteit is afwezig of minimaal, terwijl de extracellulaire kaliumconcentratie blijft toenemen (ROI2 en ROI3). Echter, in het gebied ver van de activiteitenplekken (ROI4), noch de neuronale calciumactiviteit noch de extracellulaire kaliumconcentratie is toegenomen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aax9757
Om toepassingen van de nanosensor uit te breiden, Liu et al. gecontroleerde neuronale calciumspiegels en extracellulaire kaliumconcentraties met behulp van zebravislarven. Hoewel een grote toename van de extracellulaire kaliumconcentratie intense neuronale activering kan veroorzaken om CSD en epilepsie te veroorzaken, er is geen direct bewijs om veranderingen in extracellulair kalium tijdens de ziekte aan te tonen. Het team ontwikkelde daarom een ziektemodel met behulp van zebravislarven om de extracellulaire kaliumconcentraties te verhogen en observeerde ziektekarakteristieke neuronale activering in specifieke hersengebieden.
Op deze manier, Jianan Liu en collega's hebben een kaliumion-nanosensor ontwikkeld met een extreem hoge gevoeligheid en selectiviteit. De externe coating van een selectief filtermembraan verhoogde de selectiviteit, gevoeligheid, en kinetiek van het apparaat voor snelle en kwantitatieve [K + ] detectie in levende cellen en intacte hersenen. De afgeschermde nanosensor zal brede toepassingen hebben in hersenonderzoek om het begrip van abnormale [K .] te verbeteren + ]-gerelateerde ziekten. De methode naast optische vezel-gebaseerde endoscoop en fotometrie zal real-time kaliumbeeldvorming mogelijk maken in vrij bewegende dieren.
© 2020 Wetenschap X Netwerk
 Verankerd door een dichte buurt:wat voorkomt dat cellen afdwalen?
Verankerd door een dichte buurt:wat voorkomt dat cellen afdwalen? Plantaardige eiwitten uitdrogen met de snelheid van het geluid
Plantaardige eiwitten uitdrogen met de snelheid van het geluid Upcycling van sponsachtig plastic schuim van schoenen, matrassen en isolatie
Upcycling van sponsachtig plastic schuim van schoenen, matrassen en isolatie Kunststoffen zijn niet wat we denken. Nieuwe studie vindt dat ze een beetje rubberachtig zijn, de weg vrijmaken voor betere producten
Kunststoffen zijn niet wat we denken. Nieuwe studie vindt dat ze een beetje rubberachtig zijn, de weg vrijmaken voor betere producten Kaas maken is afhankelijk van melkeiwitten om structuur te vormen
Kaas maken is afhankelijk van melkeiwitten om structuur te vormen
 Een miljoen jaar neerslaggeschiedenis van de moesson gereconstrueerd
Een miljoen jaar neerslaggeschiedenis van de moesson gereconstrueerd Microplastics en plastic additieven ontdekt in ascidians langs de kustlijn van Israël
Microplastics en plastic additieven ontdekt in ascidians langs de kustlijn van Israël Onderzoek suggereert dat zware regenval van tropische cyclonen de grond eronder vervormt
Onderzoek suggereert dat zware regenval van tropische cyclonen de grond eronder vervormt Hoe reproduceert de Venus Flytrap?
Hoe reproduceert de Venus Flytrap?  Nieuw onderzoek ondersteunt eerdere studies over wereldwijde zeespiegelstijging
Nieuw onderzoek ondersteunt eerdere studies over wereldwijde zeespiegelstijging
Hoofdlijnen
- Wetenschappers lokaliseren jaloezie in de monogame geest
- Hoe maak je een DNA-model van kralen en rietjes
- Op weg naar pesticidebewaking
- Waarom doden we?
- Hoe MRNA naar TRNA te vertalen
- Woestijnmieren kunnen de betrouwbaarheid van oriëntatiepunten beoordelen terwijl ze op zoek zijn naar de weg naar huis
- Studie van gierende kraanvogels onthult een band tussen paren zelfs voordat ze de paringsleeftijd hebben bereikt
- Habitat: definitie, soorten en voorbeelden
- Haaien langer in de tand dan we dachten
- Voor elektronica buiten silicium, een nieuwe mededinger komt naar voren
- De kleur van het licht veranderen

- Nanofabrieken:bacteriële infecties stoppen zonder antibiotica
- Polymeermembranen met kanalen van moleculair formaat die zichzelf assembleren

- Nieuwe designer carbon verbetert de batterijprestaties

 Een doorbraak in onderzoek naar chirale polymere dunne films zou een nieuwe generatie apparaten mogelijk kunnen maken
Een doorbraak in onderzoek naar chirale polymere dunne films zou een nieuwe generatie apparaten mogelijk kunnen maken Taiga-plantaanpassingen
Taiga-plantaanpassingen  Verschillen tussen krekels en kakkerlakken
Verschillen tussen krekels en kakkerlakken Astrofotograaf legt Musks Tesla Roadster vast terwijl hij door de ruimte beweegt
Astrofotograaf legt Musks Tesla Roadster vast terwijl hij door de ruimte beweegt Verschillen in herstel van kuststromen in centraal Californië
Verschillen in herstel van kuststromen in centraal Californië NASA vindt zware regenval rond het centrum van de tropische cycloon Joaninhas
NASA vindt zware regenval rond het centrum van de tropische cycloon Joaninhas Hoe deioniseren van water
Hoe deioniseren van water  Röntgenanalyse van koolstofnanostructuren helpt bij het ontwerpen van materialen
Röntgenanalyse van koolstofnanostructuren helpt bij het ontwerpen van materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

