
Wetenschap
Faagcapside tegen griep:perfect passende remmer voorkomt virale infectie
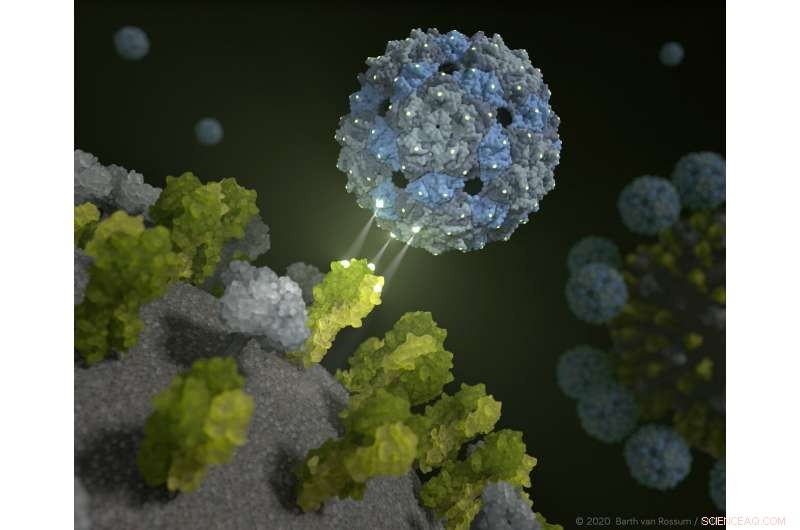
Faagschil dokt aan en remt het influenzavirus. Credit:Barth van Rossum / FMP
Een nieuwe benadering biedt hoop op nieuwe therapeutische opties voor het onderdrukken van seizoensgriep en vogelgriep. Op basis van een leeg en dus niet-infectieus omhulsel van een faagvirus, onderzoekers uit Berlijn hebben een chemisch gemodificeerde faagcapside ontwikkeld die griepvirussen verstikt.
Perfect passende bindingsplaatsen zorgen ervoor dat influenzavirussen zodanig worden omhuld door de faagcapsiden dat het voor hen praktisch onmogelijk is om longcellen te infecteren. Dit fenomeen is bewezen in preklinische onderzoeken met menselijk longweefsel. Onderzoekers van het Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP), Freie Universität Berlijn, Technische Universität Berlijn (TU), Humboldt-Universität (HU), het Robert Koch Institute (RKI) en Charité-Universitätsmedizin Berlin melden dat de resultaten ook worden gebruikt voor het directe onderzoek naar het coronavirus. De bevindingen zijn nu gepubliceerd in Natuur Nanotechnologie .
Influenzavirussen zijn nog steeds zeer gevaarlijk. De Wereldgezondheidsorganisatie (WHO) schat dat griep verantwoordelijk is voor tot wel 650, 000 doden per jaar wereldwijd. De huidige antivirale middelen zijn slechts gedeeltelijk effectief omdat ze het griepvirus aanvallen nadat longcellen zijn geïnfecteerd. Het zou wenselijk zijn - en veel effectiever - om infectie in de eerste plaats te voorkomen.
Dat is precies wat de nieuwe aanpak uit Berlijn belooft. De faagcapside, ontwikkeld door een multidisciplinair team van onderzoekers, omhult griepvirussen zo perfect dat ze geen cellen meer kunnen infecteren. "Preklinische onderzoeken tonen aan dat we in staat zijn om zowel seizoensgriepvirussen als vogelgriepvirussen onschadelijk te maken met onze chemisch gemodificeerde faagschil, " verklaarde professor Dr. Christian Hackenberger, Afdelingshoofd Chemische Biologie aan het Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) en Leibniz Humboldt Professor voor Chemische Biologie aan de HU Berlijn. "Het is een groot succes dat geheel nieuwe perspectieven biedt voor de ontwikkeling van innovatieve antivirale middelen."
Meerdere bindingen passen als klittenband
De nieuwe remmer maakt gebruik van driewaardige receptoren op het oppervlak van het griepvirus, aangeduid als hemagglutinine-eiwit, die zich hechten aan suikermoleculen (siaalzuren) op de celoppervlakken van longweefsel. In het geval van infectie, virussen haken in op hun slachtoffer - in dit geval longcellen, zoals een klittenband. Het kernprincipe is dat deze interacties optreden als gevolg van meerdere bindingen, in plaats van enkele obligaties.
Het was de oppervlaktestructuur van griepvirussen die de onderzoekers meer dan zes jaar geleden inspireerde om de volgende eerste vraag te stellen:Zou het niet mogelijk zijn om een remmer te ontwikkelen die zich perfect aan trivalente receptoren bindt, het oppervlak van longweefselcellen simuleren?
Ze ontdekten dat dit inderdaad mogelijk is met behulp van een ongevaarlijke darmbewoner:de Q-bèta-faag heeft de ideale oppervlakte-eigenschappen en is uitstekend geschikt om hem uit te rusten met liganden, in dit geval suikermoleculen - als "aas". Een lege faagschaal doet het werk perfect. "Ons multivalente steigermolecuul is niet besmettelijk, en omvat 180 identieke eiwitten die precies zo zijn verdeeld als de driewaardige receptoren van het hemagglutinine op het oppervlak van het virus, " verklaarde Dr. Daniel Lauster, een voormalig Ph.D. student in de Group of Molecular Biophysics (HU) en nu een postdoc aan de Freie Universität Berlin. "Het heeft daarom de ideale startomstandigheden om het griepvirus te misleiden - of, om preciezer te zijn, om eraan te bevestigen met een perfecte ruimtelijke pasvorm. Met andere woorden, we gebruiken een faagvirus om het griepvirus uit te schakelen!"
Om de Q-beta steiger de gewenste functie te laten vervullen, het moet eerst chemisch worden gewijzigd. Geproduceerd uit E. coli-bacteriën aan de TU Berlijn, De onderzoeksgroep van professor Hackenberger bij FMP en HU Berlijn gebruikt synthetische chemie om suikermoleculen te hechten aan de gedefinieerde posities van de virusschil.
Virus is misleid en omhuld
Verschillende onderzoeken met diermodellen en celculturen hebben aangetoond dat de op geschikte wijze gemodificeerde bolvormige structuur een aanzienlijke bindingssterkte en remmend vermogen bezit. De studie stelde het Robert Koch Institute ook in staat om het antivirale potentieel van faagcapsiden tegen veel huidige influenzavirusstammen te onderzoeken, en zelfs tegen vogelgriepvirussen. Het therapeutisch potentieel is zelfs bewezen op menselijk longweefsel, als collega-onderzoekers van de medische afdeling, Afdeling Infectiologie en Pneumologie, van Charité konden aantonen:Wanneer weefsel geïnfecteerd met griepvirussen werd behandeld met de faagcapside, de griepvirussen konden zich praktisch niet meer voortplanten.
De resultaten worden ondersteund door structureel bewijs door FU-wetenschappers van het Research Center of Electron Microscopy (FZEM):Cryo-elektronenmicroscopie met hoge resolutie en cryo-elektronenmicroscopie laten direct en ruimtelijk zien dat de remmer het virus volledig inkapselt. In aanvulling, wiskundig-fysische modellen werden gebruikt om de interactie tussen griepvirussen en het faagcapside op de computer te simuleren. "Onze computerondersteunde berekeningen laten zien dat de rationeel ontworpen remmer inderdaad hecht aan de hemagglutinine, en omhult het griepvirus volledig, "Bevestigde Dr. Susanne Liese van de AG Netz van de Freie Universität Berlin. "Het was daarom ook mogelijk om de hoge hechtsterkte wiskundig te beschrijven en te verklaren."
Therapeutisch potentieel vereist verder onderzoek
Deze bevindingen moeten nu worden opgevolgd door meer preklinische studies. Het is nog niet bekend, bijvoorbeeld, of de faagcapside bij zoogdieren een immuunrespons uitlokt. Ideaal, deze reactie zou zelfs het effect van de remmer kunnen versterken. Echter, het kan ook zo zijn dat een immuunrespons de werkzaamheid van faagcapsiden vermindert bij herhaalde blootstelling aan doses, of dat griepvirussen resistentie ontwikkelen. En, natuurlijk, het moet nog worden bewezen dat de remmer ook bij mensen effectief is.
Niettemin, de alliantie van Berlijnse onderzoekers is zeker dat de aanpak een groot potentieel heeft. "Onze rationeel ontwikkelde, driedimensionaal, multivalente remmer wijst op een nieuwe richting in de ontwikkeling van structureel aanpasbare influenzavirusbinders. Dit is de eerste prestatie in zijn soort in multivalentieonderzoek, " benadrukte professor Hackenberger. De chemicus gelooft dat deze benadering, die biologisch afbreekbaar is, niet-toxisch en niet-immunogeen in celkweekstudies, kan in principe ook worden toegepast op andere virussen, en mogelijk ook voor bacteriën. Het is duidelijk dat de auteurs de toepassing van hun benadering van het huidige coronavirus als een van hun nieuwe uitdagingen zien. Het idee is om een medicijn te ontwikkelen dat voorkomt dat coronavirussen zich binden aan gastheercellen in de keel en de daaropvolgende luchtwegen, waardoor infectie wordt voorkomen.
 Chemicaliën in Dry-Erase Markers
Chemicaliën in Dry-Erase Markers  Ontdekking opent nieuwe wegen voor het ontwerpen van medicijnen om resistente malaria te bestrijden
Ontdekking opent nieuwe wegen voor het ontwerpen van medicijnen om resistente malaria te bestrijden Grams converteren naar AMU
Grams converteren naar AMU  TNT zou na 116 jaar op pensioen kunnen gaan
TNT zou na 116 jaar op pensioen kunnen gaan Ontwikkeling van nieuw eiwit kan leiden tot nieuwe behandelingsopties voor kanker, aangeboren afwijkingen
Ontwikkeling van nieuw eiwit kan leiden tot nieuwe behandelingsopties voor kanker, aangeboren afwijkingen
 Minder biobrandstoffen, meer groene ruimte:onderzoeker klimaatactie roept op tot dringende verandering
Minder biobrandstoffen, meer groene ruimte:onderzoeker klimaatactie roept op tot dringende verandering Coronavirus en de impact ervan op de CO2-uitstoot
Coronavirus en de impact ervan op de CO2-uitstoot Overheidsrapport ziet drastische impact van klimaatverandering in VS:NYT
Overheidsrapport ziet drastische impact van klimaatverandering in VS:NYT Aardbevingen op de Mississippi:de nieuwe seismische zone van Madrid
Aardbevingen op de Mississippi:de nieuwe seismische zone van Madrid  De openbaring van de aardkorstgeometrie van het westelijke Qilian-gebergte, NE Tibetaans Plateau
De openbaring van de aardkorstgeometrie van het westelijke Qilian-gebergte, NE Tibetaans Plateau
Hoofdlijnen
- Vleermuizen en insecten vechten in de tropen
- Verschil tussen transcriptie en DNA-replicatie
- Probeer deze 5 dagelijkse gewoonten om je leven dit jaar te verbeteren
- Wat zijn de verschillen tussen een centraal zenuwstelsel en een centraal zenuwstelsel?
- Vijf olifanten gedood door trein in India
- Hoe u een mRNA-reeks kunt berekenen
- Live 3D-beeldvorming benadrukt cellulaire activiteit tijdens embryonale hartontwikkeling
- Wetenschappers identificeren sleutelfactoren die microben helpen gedijen in ruwe omgevingen
- Invasieve wormen verspreiden zich in arboretumbossen, beperkte effecten tot nu toe
- Geneesmiddelkandidaat krimpt tumor wanneer het wordt afgeleverd door nanodeeltjes van plantenvirus

- Nieuwe microfluïdische methode breidt toolbox uit voor manipulatie van nanodeeltjes
- Natuurkundigen bouwen elektronische synapsen voor neurale netwerken
- Nieuw brandstofcelontwerp aangedreven door in grafeen gewikkelde nanokristallen

- Het synthetiseren van puur grafeen, een wonder materiaal

 Welke energietransformaties vinden plaats tijdens de fotosynthese?
Welke energietransformaties vinden plaats tijdens de fotosynthese?  Een besturingssysteem om de efficiëntie van golfenergieconverters te verbeteren
Een besturingssysteem om de efficiëntie van golfenergieconverters te verbeteren China haast zich om overstromingen in te dammen na recordregen
China haast zich om overstromingen in te dammen na recordregen Goede verbindingen sleutel tot succes bij opstarten
Goede verbindingen sleutel tot succes bij opstarten Kunnen verzekeringspremies ervoor zorgen dat we klimaatverandering heelhuids doorkomen?
Kunnen verzekeringspremies ervoor zorgen dat we klimaatverandering heelhuids doorkomen? Een groeiend probleem:de ecologische voetafdruk van cannabisboerderijen verlichten
Een groeiend probleem:de ecologische voetafdruk van cannabisboerderijen verlichten Observatorium op grote hoogte werpt licht op de oorsprong van overtollige antimaterie
Observatorium op grote hoogte werpt licht op de oorsprong van overtollige antimaterie Hoe AI je kan helpen gebarentaal te leren
Hoe AI je kan helpen gebarentaal te leren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

