
Wetenschap
Selectief doden van kankercellen door hun afvalverwerkingssysteem te vervuilen
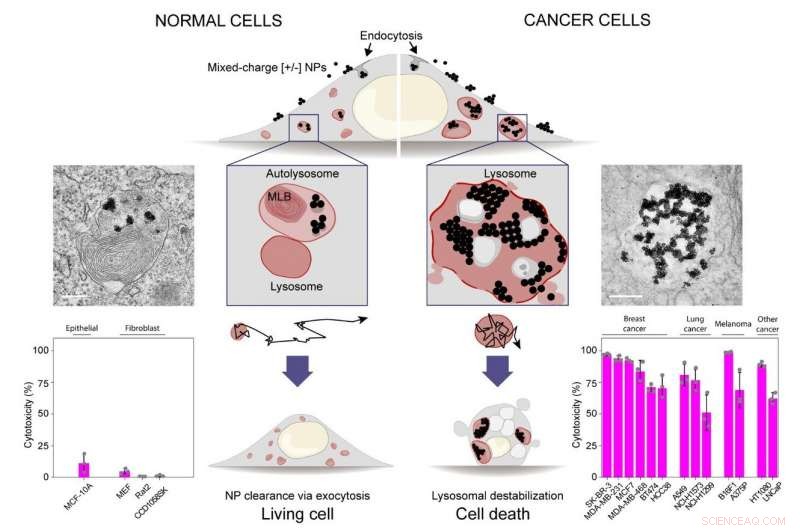
Nanodeeltjes met gemengde lading voor het destabiliseren van kankerlysosomen en het selectief doden van kankercellen. Histogrammen in de onderste rij laten zien dat nanodeeltjes met gemengde lading selectief dertien kankercellijnen doden (histogram rechts), terwijl het vier normale epitheliale of fibroblastceltypes/lijnen niet schaadt (histogram aan de linkerkant). Krediet:IBS
Een team van onderzoekers van het Centre for Soft and Living Matter, binnen het Instituut voor Basiswetenschappen (IBS, Zuid-Korea) en verbonden aan het Ulsan National Institute of Science and Technology (UNIST) heeft een nieuwe benadering ontdekt om verschillende soorten kankercellen selectief te targeten en te doden.
Lysosomen zijn kleine zakjes gevuld met een groot aantal enzymen en zuren die werken om beschadigde en ongewenste cellulaire componenten af te breken en te recyclen. Met andere woorden, ze zijn tegelijkertijd zowel de afvalcontainer van een cel als het recyclingcentrum. Typisch, lysosomen ontdoen zich van de bijproducten van dit afbraakproces door ze buiten de cel af te geven. Het afval buiten zetten heeft alleen maar zin. Bijvoorbeeld, stel je voor dat je al het afval in je huis in een prullenbak verzamelt en dan diezelfde prullenbak op de vloer in de keuken leegt, uw levensomstandigheden erbarmelijk maken. evenzo, het doorboren van de lysosomen en het vrijgeven van hun giftige inhoud in de cel beschadigt cellulaire componenten onherstelbaar die, in extreme gevallen, celdood kan veroorzaken.
Omdat kankerlysosomen gemakkelijker te beschadigen zijn dan lysosomen van gezonde cellen, wetenschappers hebben gekeken naar het gebruik van deze strategie als een veelbelovend alternatief voor het aanpakken van kankers die resistent zijn tegen conventionele behandelingen. Echter, slechts een handvol potentiële therapieën kan zich richten op lysosomen, en de meeste van hen missen kankerselectiviteit.
Gepubliceerd in Natuur Nanotechnologie , deze studie toont aan dat nanodeeltjes bedekt met een mengsel van positief [+] en negatief [-] geladen moleculen kankercellen selectief kunnen doden door zich op hun lysosomen te richten. De dood van kankercellen is het gevolg van een opmerkelijke opeenvolging van transport- en aggregatieverschijnselen, beginnend met de vorming van kleine nanodeeltjesclusters op celoppervlakken en culminerend met de assemblage van micron-sized nanodeeltjeskristallen in de kankerlysosomen. Nanodeeltjeskristallen veroorzaken lysosomale zwelling, geleidelijk verlies van de integriteit van lysosomale membranen, en uiteindelijk celdood.
"In dit werk, we hebben het gedereguleerde afvalbeheersysteem van de kankercellen gebruikt om te fungeren als een "assemblagelijn op nanoschaal" voor het bouwen van hoogwaardige nanodeeltjeskristallen die de zeer lysosoom "reactoren" vernietigen waardoor ze in de eerste plaats konden groeien, " zegt Bartosz A. Grzybowski, mede-hoofdauteur van de studie.
De aggregatie van nanodeeltjes met gemengde lading wordt bevorderd door de zure omgeving die typisch is voor kankercellen. "Niet-kankercellen, echter, internaliseren ook gemengde lading nanodeeltjes, maar de aggregatie van nanodeeltjes is beperkt. De nanodeeltjes gaan snel door de recyclingroutes en worden uit deze cellen verwijderd, " legt Kristiana Kandere-Grzybowska uit, mede-hoofdauteur van de studie.
"Onze conclusies zijn gebaseerd op een vergelijking van dertien verschillende sarcomen, melanoma, borst- en longcarcinoomcellijnen met vier niet-kankerceltypes, " voegt de eerste auteur van de studie toe, Magdalena Borkowska. "De nanodeeltjes waren effectief tegen alle dertien kankerlijnen, terwijl het niet-kankercellen niet schaadt."
De aggregatie van de nanodeeltjes terwijl ze door het endolysosomale systeem van kankercellen gaan, is een complex proces. Het team ontdekte dat nanodeeltjes met een oppervlaktesamenstelling van ongeveer 80% [+] en 20% [-] liganden een optimale kankerselectiviteit vertonen. Het feit dat negatief geladen liganden ook pH-gevoelig zijn, lijkt de sleutel te zijn tot kankerselectiviteit. In de zure pH, gevonden rond kankercellen en in de lysosomen, deze liganden zijn geprotoneerd en gevoelig voor interactie met vergelijkbare liganden op de naburige nanodeeltjes, waardoor hun aggregatie wordt bevorderd. De balans tussen aantrekkelijke interacties - de bindingen tussen [-] liganden en sterke interacties tussen nanodeeltjeskernen - en elektrostatische afstoting tussen [+] liganden op de naburige deeltjes bepalen de mate van aggregatie van nanodeeltjes. Algemeen, de interacties tussen deeltjes, serumeiwitten en de interne omgeving van cellen werken samen om kankerlysosomen te schaden.
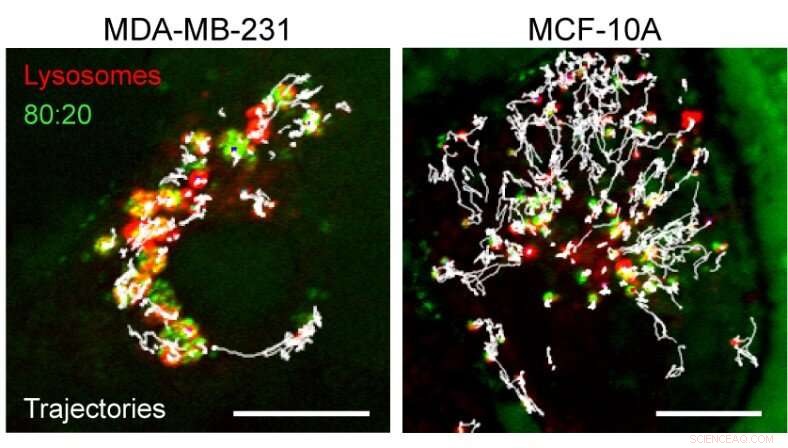
Het effect van aggregatie van nanodeeltjes in lysosomen. De afbeelding toont de trajecten (wit) van lysosomen (rood) in kanker (links) versus normale (rechts) cellen. Nanodeeltjesaggregaten (groen) in kankercellen verminderden het vermogen van lysosomen om het binnenste van de cel te onderzoeken. Schaalbalk, 10 u. Krediet:IBS
"De nanodeeltjesclusters kunnen de lipidesamenstelling van het lysosoommembraan veranderen, de integriteit aantasten en mechanisch minder robuust maken. Onverwacht, ons team ontdekte ook dat sommige eiwitten, zoals de signaalmoleculen voor celgroei mTORC1, worden verplaatst (en dus geremd) van het oppervlak van kankerlysosomen die nanodeeltjes bevatten. Dit is belangrijk omdat voor de groei en deling van kankercellen mTORC1 nodig is, en nanodeeltjes sluiten het alleen af in kankercellen, " legt Kandere-Grzybowska uit.
Terwijl enkele nanodeeltjes ongeveer even groot zijn als een gemiddeld eiwitmolecuul, en dus te klein om gezien te worden met de meeste dynamische live-celmicroscopiebenaderingen, de kristallen bestaande uit verschillende nanodeeltjes kunnen worden waargenomen. Het team gebruikte een combinatie van complementaire benaderingen, inclusief donkerveldmicroscopie, confocale reflectiemicroscopie, en TEM, evenals biochemische en computationele benaderingen om de volledige impact van nanodeeltjes met gemengde lading op lysosomale organellen te beoordelen.
Deze studie opent nieuwe onderzoeksrichtingen. De mixed-charge-strategie kan worden toegepast op andere soorten nanodeeltjes, zoals op polymeer gebaseerde deeltjes, dendrimeren of ijzeroxide nanodeeltjes. Een andere belangrijke stap is het testen van de effectiviteit van mixed-charge nanodeeltjes tegen tumoren in diermodellen.
 Uit onderzoek blijkt dat Noord-Atlantische oscillatie de reproductie van bomen in heel Europa synchroniseert
Uit onderzoek blijkt dat Noord-Atlantische oscillatie de reproductie van bomen in heel Europa synchroniseert Icy Ocean Worlds seismometer doorstaat verdere tests in Groenland
Icy Ocean Worlds seismometer doorstaat verdere tests in Groenland De pirarucu:de gigantische gewaardeerde vis van de Amazone
De pirarucu:de gigantische gewaardeerde vis van de Amazone Honderden vogels getroffen na olieramp Rotterdam
Honderden vogels getroffen na olieramp Rotterdam Alarmen gaan af omdat ijsverlies op Groenland 40% van de zeespiegelstijging in 2019 veroorzaakt
Alarmen gaan af omdat ijsverlies op Groenland 40% van de zeespiegelstijging in 2019 veroorzaakt
Hoofdlijnen
- Nieuwe statistische methode voor het evalueren van reproduceerbaarheid in studies van genoomorganisatie
- Woordproblemen schrijven voor Math
- Hoe gedraag je je in een dierentuin - volgens de wetenschap
- 10 fascinerende feiten over de nieuwe levensboom-evolutiekaart
- Genezing van verbrande poten met vissenhuid
- milities, stropers richten grote schade aan in het wild in Centraal-Afrika:monitor
- Een bacterieel stroomdiagram maken
- Hoe diepe hersenstimulatie werkt
- Waarvan zijn nucleïnezuren gemaakt?
- Hardnekkige cellulose afbreken in timelapse

- JILA kort, flexibel, herbruikbare AFM-sonde
- Venus-flytrap-achtige grijper zou individuele cellen in het menselijk lichaam kunnen vangen
- Een kleurenprinter maken die een kleurloze, niet-giftige inkt geïnspireerd door de natuur
- Stealth-sonde op nanoschaal glijdt naadloos in celwanden

 Een nieuwe katalysator voor ethanol uit biomassa
Een nieuwe katalysator voor ethanol uit biomassa Mars-gebonden:NASA's levenszoekende rover Perseverance klaar voor lancering
Mars-gebonden:NASA's levenszoekende rover Perseverance klaar voor lancering Tekenen van droogte vanuit de ruimte
Tekenen van droogte vanuit de ruimte Kun je geen tijd vinden voor de mensen die er het meest toe doen? Daar is een app voor
Kun je geen tijd vinden voor de mensen die er het meest toe doen? Daar is een app voor Dit is waarom we niet alleen op steden kunnen vertrouwen om klimaatverandering aan te pakken
Dit is waarom we niet alleen op steden kunnen vertrouwen om klimaatverandering aan te pakken Een model van een atoom maken van Styrofoam
Een model van een atoom maken van Styrofoam  Wetenschappers zeggen dat oceanen nog sneller opwarmen dan we dachten
Wetenschappers zeggen dat oceanen nog sneller opwarmen dan we dachten  Ongebruikelijke alliantie om blauwe vinvissen te redden die zijn vastgelopen door Sri Lanka
Ongebruikelijke alliantie om blauwe vinvissen te redden die zijn vastgelopen door Sri Lanka
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

