
Wetenschap
Tijdmachine voor pancreaskanker onthult plotwending in celgroei en invasie
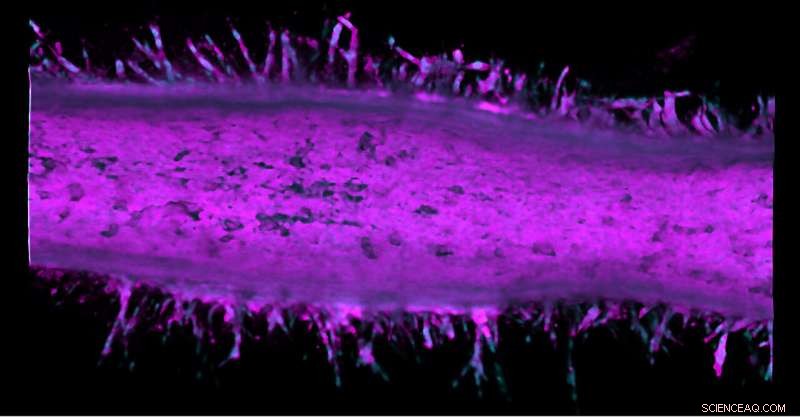
Invasieve kanker ontspruit uit een kunstmatige ductus pancreaticus, ontwikkeld door onderzoekers van Purdue University. De cellichamen zijn magenta gekleurd en de kernen zijn blauw gekleurd. Krediet:Purdue University-afbeelding / Stephanie Venis, Hye-ran Moon en Bumsoo Han
Pancreaskanker heeft een van de slechtste overlevingspercentages onder kankers. Patiënten kunnen een kans van slechts 9% verwachten om gedurende ten minste vijf jaar na de diagnose te leven.
Teruggaan in de tijd om te zien hoe cellen met belangrijke genmutaties op elkaar inwerken en invasief worden, zou onderzoekers helpen beter te begrijpen hoe de kanker begint en deze eerder te identificeren.
Een alvleesklierkanker "tijdmachine" ontwikkeld door Purdue University onderzoekers heeft onthuld dat de ziekte nog onvoorspelbaarder is dan eerder werd gedacht:kankercellen bevorderen elkaars invasiviteit wanneer ze samen groeien.
De studie, gepubliceerd in het tijdschrift Klein , is slechts het begin van een nieuwe ontdekking over hoe alvleesklierkanker evolueert. Sinds de publicatie van de krant, de onderzoekers hebben ook resistentie tegen geneesmiddelen gevonden in kankerceltypen die afkomstig zijn van twee medicijngevoelige.
De tijdmachine is een holle buis van collageen die op realistische wijze de microanatomie van een ductus pancreaticus nabootst. Door kankercellijnen te injecteren in microfluïdische kanalen in het kunstmatige kanaal, de onderzoekers kunnen het systeem gebruiken als een model om te observeren hoe alvleesklierkanker zich in de loop van de tijd gedraagt.
Typisch, het duurt 10-20 jaar voordat alvleesklierkanker zich bij een patiënt ontwikkelt. Zelfs in een diermodel, het proces duurt enkele maanden. Dit pancreastumormodel verkort de ontwikkeling van kanker tot slechts twee weken.
"We kunnen gedurende een lange periode observeren wat er gebeurt. Dit helpt ons om trends te zien die we normaal niet zouden zien, " zei Bumsoo Han, een Purdue-hoogleraar werktuigbouwkunde die modellen bouwt om te bestuderen hoe kankercellen in biologische systemen bewegen.
Het tumormodel versnelt de tijd omdat onderzoekers cellijnen van een diermodel of patiënt kunnen laden zonder eerst te wachten tot genmutatie plaatsvindt. Door de levensechte structuur van het tumormodel kunnen de onderzoekers de mutatie reconstrueren zoals dat in het lichaam zou gebeuren.
Om terug te gaan in de tijd, de onderzoekers spoelen alleen de beelden terug die zijn gemaakt door beeldvormingsapparatuur vanaf de zijkant van het kunstmatige kanaal.
Voor deze studie is een groep onder leiding van Stephen Konieczny, een professor in de biologische wetenschappen aan de Purdue, ontwikkelde de pancreascellijn in een muismodel. Han's team laadde vervolgens de cellijn door de microfluïdische kanalen van de kunstmatige ductus pancreaticus. Eenmaal binnen, de cellijnen vullen het kanaal en beginnen te groeien.
Wat het tumormodel zo realistisch maakt, is de vorm.
"De kromming van de ductus pancreaticus beïnvloedt het gedrag van cellen. We zouden deze kankercellen kunnen kweken op een petrischaaltje, maar omdat de schaal plat is, we zouden niet hetzelfde gedrag zien, " zei Han, die de programmaleider is van het Purdue University Center for Cancer Research en een beleefdheidsaanstelling heeft in biomedische technologie.
De onderzoekers zagen dat nadat twee verschillende soorten kankercellen waren samengevoegd tot het modelapparaat voor pancreastumoren, deze cellen werden invasiever en ontsproten uit het kanaal om tumoren te vormen.
Aangezien kanker technisch gezien een groep ziekten is, en pancreaskanker omvat vier belangrijke drivermutaties, Het team van Han is van plan om verder te onderzoeken hoe elk van deze mutaties op elkaar inwerkt. Het tumormodel kan ook worden gebruikt als een prescreeningtool om nieuwe medicijndoelen voor betere medicijnen te ontdekken, zei Han.
 Onderzoekers zetten belangrijke stap in de richting van kankerbehandelingen die gezonde cellen ongedeerd laten
Onderzoekers zetten belangrijke stap in de richting van kankerbehandelingen die gezonde cellen ongedeerd laten Levende sensor kan mogelijk milieurampen door brandstofverspilling voorkomen
Levende sensor kan mogelijk milieurampen door brandstofverspilling voorkomen Op papier gebaseerde tuberculosetest kan diagnoses in ontwikkelingslanden stimuleren
Op papier gebaseerde tuberculosetest kan diagnoses in ontwikkelingslanden stimuleren Vissen naar één slechte cel uit triljoenen goede
Vissen naar één slechte cel uit triljoenen goede Onderzoek naar ijzer-zwavelcluster biedt nieuwe mogelijkheden om ziekten te onderzoeken
Onderzoek naar ijzer-zwavelcluster biedt nieuwe mogelijkheden om ziekten te onderzoeken
 NASA volgt extra-tropische cycloon Lan die door Noord-Japan raast
NASA volgt extra-tropische cycloon Lan die door Noord-Japan raast Nieuwe analyse ondersteunt mangrovebossen, schorren en zeegrasweiden als effectieve klimaatbuffers (Update)
Nieuwe analyse ondersteunt mangrovebossen, schorren en zeegrasweiden als effectieve klimaatbuffers (Update) Gouverneur Georgië roept noodtoestand uit voor orkaan
Gouverneur Georgië roept noodtoestand uit voor orkaan Ring rond badkuip bij gigantisch vulkaanveld toont beweging van ondergronds magma
Ring rond badkuip bij gigantisch vulkaanveld toont beweging van ondergronds magma Microben ondergaan verschillende onherbergzame omstandigheden in het Mono Lake in Californië
Microben ondergaan verschillende onherbergzame omstandigheden in het Mono Lake in Californië
Hoofdlijnen
- Inspanningen om zeeschildpadden te redden zijn een wereldwijd succesverhaal op het gebied van natuurbehoud:wetenschappers
- Wetenschappers ontwikkelen nieuwe aanpak om belangrijke onontdekte functies van eiwitten te identificeren
- VS overweegt de bescherming van beren in het noordwesten van Montana te beëindigen
- Hoe de cellen van planten, dieren en eencellige organismen te vergelijken
- Waarom is het zo moeilijk voor soorten om hun ecologische niche te verlaten?
- Specialiteiten van de rechterkant van de hersenen
- Wat is het verschil tussen Ribosoom en Ribosomaal DNA?
- Cilia: definitie, types en functie
- De ontdekking van een mijlpaal verandert de evolutiemarathon in een sprint
- Nieuwe technologie verlengt de levensduur van de batterij voor mobiele apparaten aanzienlijk

- Vooruitgang op nanoformaat richting het volgende grote behandeltijdperk in de tandheelkunde
- Superieure ruiscontrole met behulp van grafeen

- Licht buigen rond krappe hoeken zonder terugverstrooiingsverliezen
- Van katalysatoren en chiraliteit:zeer selectieve groei van structuurspecifieke enkelwandige koolstofnanobuizen

 Mensen in de pro-Trump-delen van de VS bleven minder thuis en kregen meer COVID
Mensen in de pro-Trump-delen van de VS bleven minder thuis en kregen meer COVID Science Fair-projecten over bonen groeien en de levenscyclus
Science Fair-projecten over bonen groeien en de levenscyclus De paardenkracht van een compressor berekenen
De paardenkracht van een compressor berekenen  Mechanisme Beschrijving van een handmatige blikopener
Mechanisme Beschrijving van een handmatige blikopener  Informatie over hydraulische aansluitingen
Informatie over hydraulische aansluitingen Studie onthult enorme diversiteit aan oceaanmicroben
Studie onthult enorme diversiteit aan oceaanmicroben Het luchthavenplan van Chicago is een van de vele droomprojecten van Musk
Het luchthavenplan van Chicago is een van de vele droomprojecten van Musk Wat doet E = MC Squared voor?
Wat doet E = MC Squared voor?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

