
Wetenschap
Nieuw transportmechanisme van een nanomateriaal door een celmembraan:membraanrekking
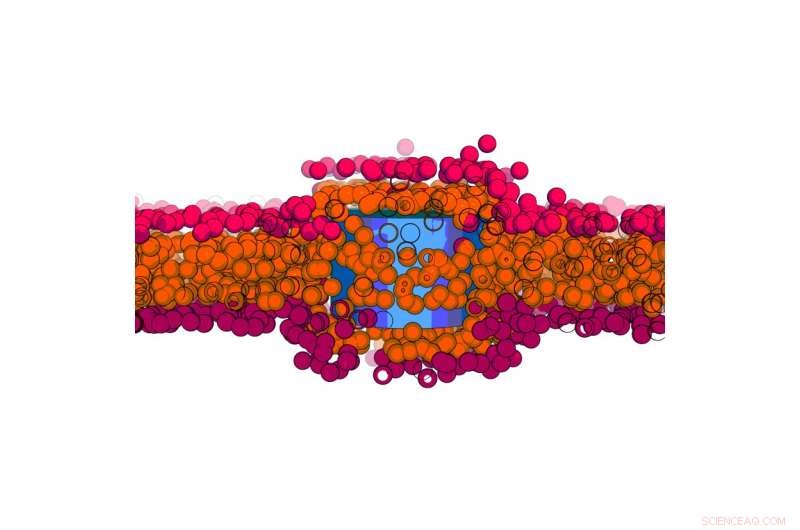
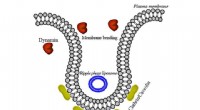
Nanobuisjes opgesloten in het membraan. Krediet:URV
Het vergroten van het bewustzijn van bio-effecten en toxiciteit van nanomaterialen die in wisselwerking staan met cellen, legt de nadruk op de mechanismen waarmee nanomaterialen lipidemembranen kunnen passeren. Afgezien van goed besproken energieafhankelijke endocytose voor grote objecten en passieve diffusie door membranen door opgeloste moleculen, er zijn andere transportmechanismen die gebaseerd zijn op fysische principes. Een team van theoretische natuurkunde aan de Universitat Rovira i Virgili in Tarragona, geleid door Dr. Vladimir Baulin, ontwierp een onderzoeksproject om de interactie tussen nanobuisjes en lipidemembranen te onderzoeken. Bij computersimulaties de onderzoekers bestudeerden wat zij een "model dubbellaag" noemen, samengesteld uit slechts één type lipide. Op basis van hun berekeningen het team merkte op dat een ultrakorte nanobuis (lengte van 10 nm) loodrecht op de lipide dubbellaagkern kan worden geplaatst.
Ze zagen dat deze nanobuisjes gevangen blijven in het celmembraan, zoals algemeen aanvaard door de wetenschappelijke gemeenschap. Maar toen ze hun modelcelmembraan oprekten, nanobuisjes die vastzaten in de dubbellaag begonnen plotseling aan beide kanten te ontsnappen. Dit betekent dat het mogelijk is om het transport van een nanomateriaal over een celmembraan te regelen door de membraanspanning af te stemmen.
Dr. Baulin nam contact op met Dr. Jean-Baptiste Fleury van de Universiteit van Saarland (Duitsland) om dit mechanisme te bevestigen en om dit spanningsgemedieerde transportfenomeen experimenteel te bestuderen. Dr. Fleury en zijn team ontwierpen een microfluïdisch experiment met een goed gecontroleerde fosfolipide dubbellaag, een experimenteel model voor celmembranen, en ultrakleine koolstofnanobuisjes (10 nm lang) in oplossing toegevoegd. De nanobuisjes hadden een geadsorbeerde lipide-monolaag die hun stabiele dispersie garandeert en hun clustering voorkomt. Met behulp van een combinatie van optische fluorescentiemicroscopie en elektrofysiologische metingen, het team zou een individuele nanobuis kunnen volgen die een dubbellaag kruist en hun pad op moleculair niveau ontrafelen. En zoals voorspeld door de simulaties, ze merkten op dat nanobuisjes de dubbellaag binnengingen door hun lipidecoating op te lossen in het kunstmatige membraan. Wanneer een spanning van 4 mN/m werd toegepast op de dubbellaag, nanobuisjes ontsnapten spontaan uit de dubbellaag in slechts enkele milliseconden, terwijl bij lagere spanningen nanobuisjes in het membraan blijven zitten.
Deze ontdekking van translocatie van kleine nanobuisjes door barrières die cellen beschermen, d.w.z. lipide dubbellagen, kan aanleiding geven tot bezorgdheid over de veiligheid van nanomaterialen voor de volksgezondheid, en suggereren nieuwe mechanische mechanismen om de medicijnafgifte te regelen.
Hoofdlijnen
- Methode stelt onderzoekers in staat lichaamsgeurmonsters van zoogdieren op een niet-invasieve manier te verzamelen
- Schapen kunnen menselijke gezichten van foto's herkennen
- Het bewijs zit in de voetafdruk:mensen kwamen eerder naar Amerika dan gedacht
- Beeldstabilisatie bij gewervelde dieren hangt af van contrast tussen objecten
- Wat doen de Centrioles tijdens de interfase?
Centriolen vormen het microtubulekelet van de cel tijdens de interfase en dupliceren tijdens de S-fase van de interfase, samen met het DNA. Interphase bestaat uit de G1-, S- en G2-fasen. Centriolen komen
- Your Brain On: Exam Stress
- Hoe zal de aarde er over 50 uitzien,
- Wat zijn schadelijke genen?
- Hoe een mRNA-sequentie
- Op DNA gebaseerde elektromechanische schakelaar gedemonstreerd

- Met suiker omhulde nanowormen niet als ontbijt in het menselijke immuunsysteem
- Een ultrasnelle glimp van de fotochemie van de atmosfeer
- Kunstmatig enzym bootst het natuurlijke ontgiftingsmechanisme in levercellen na
- De stijfheid van celplasmamembranen beïnvloedt de opname van nanomedicijnen
 Principes van stoomdestillatie
Principes van stoomdestillatie Neutronensterren naar de aarde brengen
Neutronensterren naar de aarde brengen Wat onderscheidt mensen van chimpansees en andere apen?
Wat onderscheidt mensen van chimpansees en andere apen?  Is nieuwe vondst een asteroïde of een komeet? het is beide
Is nieuwe vondst een asteroïde of een komeet? het is beide Californië registreert droogste jaar in eeuw
Californië registreert droogste jaar in eeuw Minstens 44 doden door plotselinge overstromingen in het noordoosten van de VS
Minstens 44 doden door plotselinge overstromingen in het noordoosten van de VS Zoeken naar donkere energie kan de oorsprong verlichten, evolutie, lot van het universum
Zoeken naar donkere energie kan de oorsprong verlichten, evolutie, lot van het universum DR Congo-regering geeft groen licht voor herstart kernreactor
DR Congo-regering geeft groen licht voor herstart kernreactor
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


