
Wetenschap
Nanodeeltjes misleiden lichaam om orgaantransplantaties te accepteren
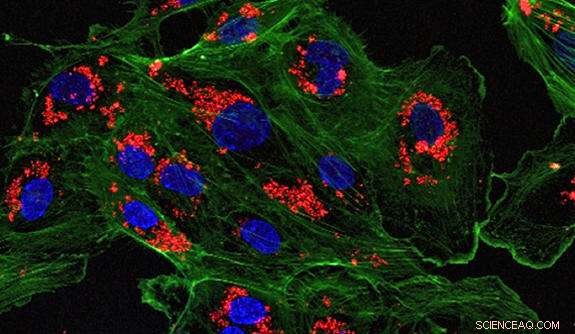
Een microscopisch beeld van endotheelcellen die zijn behandeld met met medicijnen beladen nanodeeltjes. Krediet:Saltzman Lab
Met behulp van nanodeeltjes, Yale-onderzoekers hebben een medicijnafgiftesysteem ontwikkeld dat complicaties bij orgaantransplantaties kan verminderen door het gedoneerde weefsel te verbergen voor het immuunsysteem van de ontvanger.
ongeveer 25, Jaarlijks worden in de VS 000 orgaantransplantaties uitgevoerd. Ondanks aanzienlijke vooruitgang op dit gebied, orgaanafstoting op korte en lange termijn vormt nog steeds een risico (afstotingspercentages variëren afhankelijk van het type orgaan). Het risico op afstoting is nog groter als de donor is overleden, wegens orgaanschade.
T-cellen, de witte bloedcellen die vreemde lichamen identificeren en aanvallen, zijn een van de belangrijkste boosdoeners achter orgaanafstoting. De machtigste van deze, bekend als effector geheugen T-cellen, worden geactiveerd door een groep eiwitten die bekend staat als menselijke leukocytantigenen (HLA's) op het oppervlak van endotheelcellen die de bloedvaten van het gedoneerde orgaan bekleden. Onderzoekers kunnen de eiwitten het zwijgen opleggen met klein interfererend RNA (siRNA), een dubbelstrengs RNA dat de expressie van gerichte genen belemmert. Bij conventionele levering, echter, de effecten van siRNA duren slechts enkele dagen. Een getransplanteerd orgaan van een overleden donor heeft doorgaans weken nodig om te "genezen" en het risico op afstoting te verminderen. Het siRNA kan ook bijwerkingen veroorzaken in endotheelcellen van andere organen, die geen behandeling nodig hebben, wanneer toegediend aan het hele lichaam.
Om het siRNA meer uithoudingsvermogen te geven, de onderzoekers ontwikkelden een medicijnafgiftesysteem waarin op polymeren gebaseerde nanodeeltjes siRNA naar de plaats van het transplantaat vervoeren en het medicijn langzaam afgeven. Ze ontwikkelden ook methoden om de nanodeeltjes in het donororgaan te brengen voordat het wordt getransplanteerd, zodat alleen het orgaan wordt behandeld, niet het hele lichaam. De resultaten van hun werk worden gepubliceerd in het tijdschrift Natuurcommunicatie .
De deeltjes - gemaakt in het Yale-lab van Mark Saltzman, de Goizueta Foundation Professor of Chemical and Biomedical Engineering - kan worden afgestemd op specifieke eigenschappen. Zoutman, die ook lid is van het Yale Cancer Center, zei dat deze nanodeeltjes zijn ontworpen om een lichte positieve lading te hebben om te interageren met de negatieve lading van het nucleïnezuur van het siRNA. Deze affiniteit tussen de twee materialen maakt het deeltje een natuurlijke drager voor het medicijn, in tegenstelling tot commercieel verkrijgbare nanodeeltjes die slechts een beperkte hoeveelheid van het medicijn kunnen bevatten.
Voor de studie, de onderzoekers behandelden een deel van een menselijke slagader - een paar millimeter in diameter - met de met siRNA geladen nanodeeltjes en transplanteerden het in de abdominale aorta van een immuundeficiënte muis die was ingeënt met menselijke T-cellen. De onderzoekers ontdekten dat de nanodeeltjes nog steeds aanwezig waren in het gedoneerde weefsel en de expressie van de eiwitten tot zes weken na transplantatie aanzienlijk tot zwijgen brachten. Aanvullend, er was geen schade aan de endotheelcellen van niet-gerichte organen.
De eerste weken na de transplantatie zijn cruciaal, vooral wanneer de orgaandonor is overleden, zei Jordan Pober, de Bayer hoogleraar translationele geneeskunde en hoogleraar immunobiologie, pathologie, en dermatologie aan Yale.
"Als we de start van de afwijzingsreactie uitstellen, het moet milder zijn en gemakkelijker te beheersen zijn en leiden tot minder late afstoting, " zei Pober, die co-auteur is van de studie en tevens directeur van Yale's Human and Translational Immunology-programma.
Focussen op niertransplantaties (veruit het meest voorkomende type orgaantransplantatie dat wordt uitgevoerd), Saltzman en Pober willen het toedieningssysteem toepassen op een proces dat bekend staat als ex vivo normothermische machineperfusie. Ontwikkeld voor nieren door collega's van Cambridge University, het proces omvat het pompen van warm, geoxygeneerde rode bloedcellen via een orgaan dat is verwijderd van een overleden donor om eventuele schade aan het orgaan te herstellen voordat het in de ontvanger wordt geïmplanteerd. De onderzoekers van Yale zijn van plan om de nanodeeltjes aan de rode bloedcellen toe te voegen om gecontroleerde afgifte van het siRNA aan de endotheelcellen van de nieren te geven.
 Experimentele vingerafdruktest kan onderscheid maken tussen personen die cocaïne hebben gebruikt of gebruikt
Experimentele vingerafdruktest kan onderscheid maken tussen personen die cocaïne hebben gebruikt of gebruikt Gebruik van PVC Plastic
Gebruik van PVC Plastic Team ontwikkelt machine met als doel een einde te maken aan textielverspilling
Team ontwikkelt machine met als doel een einde te maken aan textielverspilling Moleculaire energiemachine als filmster
Moleculaire energiemachine als filmster Onderzoek naar spinnenlijm lost plakkerig probleem op
Onderzoek naar spinnenlijm lost plakkerig probleem op
 Het kappen van hele bomen mag de biodiversiteit van planten niet belemmeren
Het kappen van hele bomen mag de biodiversiteit van planten niet belemmeren Zou een atmosferisch sproeiprogramma tegen de opwarming van de aarde echt kunnen werken?
Zou een atmosferisch sproeiprogramma tegen de opwarming van de aarde echt kunnen werken? EPA-chef ondertekent voorstel dat de wetenschap die bij beslissingen wordt gebruikt, beperkt
EPA-chef ondertekent voorstel dat de wetenschap die bij beslissingen wordt gebruikt, beperkt Grace herwint orkaankracht voor tweede Mexicaanse aanlanding
Grace herwint orkaankracht voor tweede Mexicaanse aanlanding Waterplanten & kinderen
Waterplanten & kinderen
Hoofdlijnen
- Wat als Homeostase mislukt?
- Wanneer werden DNA-testen het eerst gebruikt?
- Wat zijn de structurele delen van de lange botten in het lichaam?
- Hoe permeabiliteit uit te leggen
- Gemuteerd kikkergen stoot roofdieren af
- Van de omelet tot het ei:eiwitaggregaties omkeren
- Moet je intelligent zijn om slecht te zijn?
- Hoge verwachtingen van Australische poging om pandawelpen te fokken
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Oplosmiddel pH regelt interacties van gouden nanoclusters, biedt potentiële toepassingen in medicijnen en beeldvorming

- Kleinschalige beeldvorming ontsluit nikkelertswaarde

- Grafeen wordt helder:'s werelds dunste gloeilamp ontwikkeld

- Polymeerkracht:Tribo-elektrische generator produceert elektriciteit door wrijving tussen oppervlakken te benutten
- US Navy kijkt naar grafeen nanoribbon voor ultiem energiecontrolesysteem

 Een kwantummagneet met een topologische twist
Een kwantummagneet met een topologische twist Sociale binding belangrijkste oorzaak van voetbalgeweld
Sociale binding belangrijkste oorzaak van voetbalgeweld Aardbeving treft Turkse kust en Grieks eiland doden 19
Aardbeving treft Turkse kust en Grieks eiland doden 19 Afwijkende hyfen veroorzaakt door immuunreacties van de gastheer op plantpathogene schimmel
Afwijkende hyfen veroorzaakt door immuunreacties van de gastheer op plantpathogene schimmel De uitdaging:een medische isotoop maken en zuiveren die dezelfde dag nog gebruikt moet worden
De uitdaging:een medische isotoop maken en zuiveren die dezelfde dag nog gebruikt moet worden Bodemsoorten in gematigde loofbossen
Bodemsoorten in gematigde loofbossen Zuckerberg noemt Weegschaalmunt een sleutel voor Amerikaans leiderschap
Zuckerberg noemt Weegschaalmunt een sleutel voor Amerikaans leiderschap De gesynchroniseerde dans van skyrmion draait
De gesynchroniseerde dans van skyrmion draait
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

