
Wetenschap
Moleculaire energiemachine als filmster

Tobias Weinert, biochemicus bij PSI, met de experimentele opstelling voor de "excitation query"-kristallografie bij de SLS:een injector produceert een 50 micrometer (als een haar) dunne stroom van een tandpasta-achtige massa met de eiwitkristallen erin gegroeid. Een kleine laserdiode, vergelijkbaar met een conventionele laserpointer, wordt over spiegels en lenzen geleid en gefocust op hetzelfde punt waar de röntgenstraal van de SLS raakt (niet op de foto). Voor de foto, de laser werd zichtbaar gemaakt door vloeibare stikstof. In het experiment, de laser wordt dan voor een kort moment geactiveerd, gevolgd door de röntgenstralen voor de moleculaire film. Krediet:Paul Scherrer Instituut/Markus Fischer
Onderzoekers van het Paul Scherrer Instituut PSI hebben de Zwitserse lichtbron SLS gebruikt om een moleculaire energiemachine in actie vast te leggen en zo te onthullen hoe de energieproductie bij celmembranen werkt. Hiervoor ontwikkelden ze een nieuwe onderzoeksmethode die de analyse van cellulaire processen aanzienlijk effectiever zou kunnen maken dan voorheen. Ze hebben hun resultaten nu gepubliceerd in het tijdschrift Wetenschap .
In alle levende wezens, structurele veranderingen in eiwitten zijn verantwoordelijk voor veel biochemisch gecontroleerde functies, bijvoorbeeld energieproductie bij celmembranen. Het eiwit bacteriorodopsine komt voor in micro-organismen die op het oppervlak van meren leven, stromen, en andere wateren. Geactiveerd door zonlicht, dit molecuul pompt positief geladen deeltjes, protonen, van binnen naar buiten door het celmembraan. Terwijl je dit doet, het verandert voortdurend zijn structuur.
PSI-onderzoekers waren al in staat om een deel van dit proces op te helderen bij free-electron X-ray lasers (FEL's) zoals SwissFEL. Nu zijn ze er ook in geslaagd om het nog onbekende deel van het proces vast te leggen in een soort moleculair filmpje. Hiervoor namen ze een methode die voorheen alleen bruikbaar was bij FEL's en ontwikkelden deze verder voor gebruik bij de Swiss Light Source SLS. Het onderzoek onderstreept de synergie tussen de analytische mogelijkheden van deze twee grootschalige onderzoeksfaciliteiten van PSI. "Met de nieuwe werkwijze bij SLS, we kunnen nu het laatste deel van de beweging van bacteriorodopsine volgen, waarbij de stappen in het millisecondebereik liggen, " legt Tobias Weinert uit, eerste auteur van het artikel. "Met metingen bij FEL's in de VS en Japan, we hadden de eerste twee deelprocessen al gemeten voordat SwissFEL in gebruik werd genomen, " zegt Weinert. "Deze vinden heel snel plaats, binnen femtoseconden tot microseconden." Een femtoseconde is een biljoenste van een seconde.
Om dergelijke processen te kunnen observeren, de onderzoekers gebruiken zogenaamde "pump-probe" kristallografie. Met deze methode, ze kunnen snapshots maken van eiwitbewegingen die vervolgens kunnen worden samengevoegd tot films. Voor de experimenten, eiwitten worden in kristalvorm gebracht. Een laserstraal, het imiteren van zonlicht, triggert de opeenvolging van bewegingen in het eiwit. Röntgenstralen die het monster naderhand raken, produceren diffractiebeelden, die worden geregistreerd door een detector met hoge resolutie. Van deze, computers genereren op elk moment een beeld van de eiwitstructuur.
De film die is gemaakt op basis van de metingen bij SLS laat zien hoe de structuur van het bacteriorodopsinemolecuul verandert in de volgende 200 milliseconden nadat het door licht is geactiveerd. Met dat, een volledige zogenaamde "fotocyclus" van het molecuul is nu opgehelderd.
Bacteriorodopsine functioneert als een biologische machine die protonen van binnen de cel door het membraan naar buiten pompt. Hierdoor ontstaat een concentratiegradiënt op het celmembraan. Aan zijn buitenzijde, er zijn meer protonen dan aan de binnenkant. De cel gebruikt deze gradiënt om energie te winnen voor zijn metabolisme door protonen elders in staat te stellen de extern en intern verschillende concentraties in evenwicht te brengen. Daarbij, de cel produceert ATP, een universele energiebron in levende wezens. Vervolgens, bacteriorodopsine herstelt de concentratiegradiënt.
"In de nieuwe studie we waren nu in staat om de grootste real-time structurele veranderingen in een molecuul ooit te zien" - met "groot" bedoelt de wetenschapper negen angstrom, dat is, een miljoenste van de dikte van een mensenhaar. Door deze structurele veranderingen er ontstaat een gat in het eiwit waarin zich een keten van watermoleculen vormt, en dit is verantwoordelijk voor het protonentransport door het celmembraan. "Voor ons, niemand had deze waterketen ooit rechtstreeks waargenomen, ’ merkt de biochemicus blij op.
Deze waarnemingen werden alleen mogelijk gemaakt door de wijziging van de methode die eerder bij SwissFEL werd gebruikt voor gebruik bij SLS, en dankzij de nieuwe hoge resolutie en snelle "Eiger" detector bij SLS. Weinert is er zeker van dat de nieuwe methode voor onderzoek door middel van synchrotrons zoals SLS wereldwijd onderzoek zal inspireren. "Onderzoekers kunnen de nieuwe methode gebruiken en veel efficiënter worden, aangezien er wereldwijd veel meer synchrotrons zijn dan vrije-elektronenlasers. Daarnaast, je hebt minder eiwitkristallen nodig dan nodig zijn voor experimenten bij FEL's, ’ voegt Weinert toe.
Echter, voor de zeer snelle moleculaire processen, en om bijzonder scherpe beelden en nauwkeurige resultaten te krijgen, de onderzoekers vertrouwen op SwissFEL. "De processen aan het begin van de fotocyclus vinden plaats in een kwestie van femtoseconden. Het is alleen mogelijk om zulke snelle chemische reacties bij FEL's waar te nemen." In aanvulling, structuren kunnen worden opgenomen met een hogere resolutie bij FEL's. Omdat zoveel fotonen het monster tegelijk raken bij de lineaire versneller, de detector kan een extreem scherp beeld vastleggen.
Weinert benadrukt de synergie tussen de twee grootschalige onderzoeksfaciliteiten:"Bij SwissFEL, slechts een kleine hoeveelheid straaltijd is beschikbaar. Met de metingen bij SLS, we kunnen er op voorhand zeker van zijn dat ons experiment bij SwissFEL zal slagen. Dit komt de efficiëntie ten goede."
De onderzoekers hebben de resultaten van het onderzoek nu gepubliceerd in het tijdschrift Wetenschap .
 Het olieboorproces uitgelegd
Het olieboorproces uitgelegd  Hittegolven van het noordpoolgebied tot Japan:een teken van wat komen gaat?
Hittegolven van het noordpoolgebied tot Japan:een teken van wat komen gaat? Duizenden demonstreren tegen cruiseschepen in Venetië
Duizenden demonstreren tegen cruiseschepen in Venetië Het instorten van de oude Antarctische ijskap kan opnieuw gebeuren, een nieuwe wereldwijde overstroming veroorzaken
Het instorten van de oude Antarctische ijskap kan opnieuw gebeuren, een nieuwe wereldwijde overstroming veroorzaken Hoe komen vissen in nieuwe vijvers?
Hoe komen vissen in nieuwe vijvers?
Hoofdlijnen
- Wat is de rol van enzymen in het metabolisme?
- Fase waarin de Nucleus & Nucleolus zijn hervormd
- Welke rol speelt het ribosoom in vertaling?
- Wat zijn de spoelen van DNA in de kern?
- Dierenartsen waarschuwen dat antivries giftig is voor huisdieren en mensen
- Verdraaide seks zorgt ervoor dat slakken in spiegelbeeld face-to-face kunnen paren, onderzoek vindt
- Science Fair-projecten met nagellak
- Hoe elektroforese te analyseren
- DNA van bevroren dierentuin kan uitsterven van soorten voorkomen
- Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica

- Mangaan drukt zijn stempel op de synthese van geneesmiddelen

- Een fosfineoxidekatalysator gebruiken om nucleofiele substitutiereacties van alcoholen groener te maken

- Nieuwe hulpmiddelen om bioactieve lipiden te bestuderen

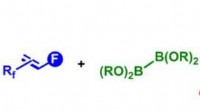
- Chemici ontsluiten het potentieel van fluoralkenen
 Herstel van DNA-schade - moleculaire inzichten
Herstel van DNA-schade - moleculaire inzichten Team onthult katalysator die problematische CF-bindingen kan verbreken
Team onthult katalysator die problematische CF-bindingen kan verbreken Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierencel?
Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierencel?  VN steunt Rusland bij internetverdrag, alarmerende voorstanders van rechten
VN steunt Rusland bij internetverdrag, alarmerende voorstanders van rechten Een nieuwe kijk op de vast-vloeistof-interface
Een nieuwe kijk op de vast-vloeistof-interface Hoe de verhouding tussen de elementen in een samenstelling te bepalen
Hoe de verhouding tussen de elementen in een samenstelling te bepalen Speciale status beschermt bossen niet tegen illegaal boomverlies
Speciale status beschermt bossen niet tegen illegaal boomverlies Diagnostisch hulpmiddel helpt ingenieurs bij het ontwerpen van betere wereldwijde infrastructuuroplossingen
Diagnostisch hulpmiddel helpt ingenieurs bij het ontwerpen van betere wereldwijde infrastructuuroplossingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

