
Wetenschap
Afweerkracht van het immuunsysteem gevangen in actie
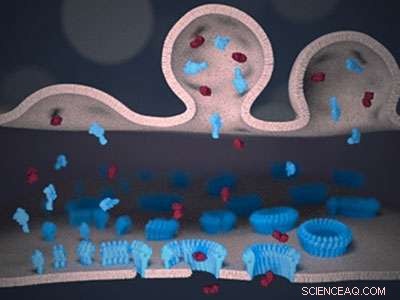
Schematische weergave van de immuunsynaps tussen een lymfocyt (boven) en een doelcel (onder). Perforine (blauw) en granzyme (rood) worden vanuit het lymfocytmembraan (boven) aan de synaps afgeleverd. Perforine bindt aan het doelmembraan (onder) en, volgens een 'groeiende porie'-mechanisme, vormt transmembraanporiën. De poriën laten de giftige granzymen het doelmembraan passeren, en celdood veroorzaken. Krediet:Adrian Hodel, UCL
Hoe de natuurlijke verdedigingskracht in ons immuunsysteem schadelijke indringers aanvalt en vernietigt, zoals met virus geïnfecteerde en kankercellen, is in microscopisch detail gevisualiseerd door wetenschappers van UCL, Birkbeck, Universiteit van Londen, Peter MacCallum Cancer Center en Monash University, Australië.
Het onderzoek, vandaag gepubliceerd in Natuur Nanotechnologie , verdiept het begrip van de cruciale rol van het eiwit 'perforine' in een functionerend immuunsysteem, brengt ons een stap dichter bij nieuwe therapieën met het potentieel om de impact ervan te versterken of te remmen wanneer dat nodig is.
Professor Bart Hoogenboom (UCL Physics &Astronomy en London Centre for Nanotechnology) en Professor Helen Saibil (Birkbeck, University of London) gebruikte atoomkrachtmicroscopie en elektronenmicroscopie om precies te onthullen hoe een subset van witte bloedcellen, genaamd cytotoxische lymfocyten (of Killer T-cellen), tonen opmerkelijke efficiëntie bij het eerst perforeren van hun slachtoffers en vervolgens het injecteren van giftige enzymen om het lichaam van ziekte te bevrijden.
Met behulp van een vorm van microscopische CCTV, er werd aangetoond hoe perforine zich bindt aan het beschermende membraan dat schadelijke cellen omgeeft. Professor Hoogenboom zei:"Ons immuunsysteem moet gaten boren in met virus geïnfecteerde en kankercellen om ze kwijt te raken. maar kan dergelijke boren niet in een bouwmarkt kopen. We hebben nu laten zien hoe het deze boren zelf assembleert ter plaatse door meerdere perforine-moleculen samen te voegen in ringachtige structuren, kleine gaatjes achterlatend - slechts tientallen nanometers in diameter."
Universitair hoofddocent Ilia Voskoboinik, een leidende co-auteur (Peter MacCallum Cancer Center), zei:"Om met virus geïnfecteerde of kankercellen te doden, perforin moet snel en efficiënt zijn. Onze experimenten in Melbourne laten zien dat patiënten die geboren worden met een verminderde perforine mogelijk een fatale uitval van het immuunsysteem hebben en ook een hoger risico lopen op het ontwikkelen van bloedkanker.
"Dit kwam volledig overeen met de microscopische gegevens die in Londen werden verkregen, waaruit blijkt dat de effectiviteit van perforine sterk wordt belemmerd, zelfs als slechts een klein aantal van de perforine-moleculen abnormaal is. Dit nieuwe begrip brengt ons een stap dichter bij gerichte therapieën die de perforine-producerende kracht van het lichaam kunnen versterken om ziekten af te weren. We kunnen ook de functie ervan remmen om de afstoting van orgaantransplantaties te voorkomen, wanneer het accepteren van vreemd weefsel of cellen in plaats daarvan levensreddend kan zijn."
Perforin in actie filmen, de wetenschappers gebruikten atoomkrachtmicroscopie in het laboratorium van professor Hoogenboom in het London Centre for Nanotechnology aan de UCL. Dit type microscopie gebruikt een ultrafijne naald om perforine op een doelmembraan te voelen in plaats van te zien. vergelijkbaar met een blinde die braille leest. De naald scant herhaaldelijk het oppervlak om een beeld te produceren dat snel genoeg ververst om te volgen hoe perforinemoleculen samenkomen en gaten in het membraan snijden.
aanvankelijk, perforin verscheen als een waas op deze afbeeldingen. Echter, zodra een paar perforinemoleculen samen in het membraan worden ingebracht, ze konden duidelijker worden geïdentificeerd en aangetoond dat ze meer perforine rekruteren om zo transmembraanporiën te laten groeien.
Door ook statische snapshots met een hogere resolutie op te nemen met behulp van elektronenmicroscopie, Het team van professor Saibil slaagde erin te schatten, voor elke perforine-assemblage, het aantal moleculen in elke fase van het proces. Dit bevestigde een verandering van los gepakte kleine perforine-assemblages op het membraan naar grotere en steviger gebonden transmembraanporiën.
 Hoe het verschil in kookpunten te rationaliseren
Hoe het verschil in kookpunten te rationaliseren  Nanosensoren verbeteren de detectie van biomarkers voor ziekten in uitgeademde adem
Nanosensoren verbeteren de detectie van biomarkers voor ziekten in uitgeademde adem Efficiëntere fotokatalysatoren kunnen het potentieel van zonne-energie ontsluiten
Efficiëntere fotokatalysatoren kunnen het potentieel van zonne-energie ontsluiten Elektrolytisch gedeponeerde oppervlakken met omkeerbaar schakelende grensvlakeigenschappen
Elektrolytisch gedeponeerde oppervlakken met omkeerbaar schakelende grensvlakeigenschappen Plastic web printen om de gsm-schermen van de toekomst te beschermen
Plastic web printen om de gsm-schermen van de toekomst te beschermen
 De lucht decoderen:de impact van waterdamp op regen in de middag
De lucht decoderen:de impact van waterdamp op regen in de middag Onderzoekers vinden natuurlijk voorkomende fotostromen in anorganische minerale systemen
Onderzoekers vinden natuurlijk voorkomende fotostromen in anorganische minerale systemen Inheemse groepen waarschuwen voor akkoord van Parijs dat in gevaar is door ontbossing
Inheemse groepen waarschuwen voor akkoord van Parijs dat in gevaar is door ontbossing Gevaarlijke afvalstortplaatsen Voordelen en nadelen
Gevaarlijke afvalstortplaatsen Voordelen en nadelen  Waterbeheer vergroot de bedrijfswinsten
Waterbeheer vergroot de bedrijfswinsten
Hoofdlijnen
- Meelkracht om voedselzekerheid te vergroten
- Het sociale leven van weesolifanten is aanzienlijk veranderd door stroperij
- Intron: definitie, functie en belang bij RNA-splitsing
- Hersenen van zombie-mieren intact gelaten door schimmelparasiet
- Zijn kleine populieren de toekomst van biobrandstoffen? Studies zeggen ja
- Nieuwe strategie zou bestaande medicijnen in staat kunnen stellen bacteriën te doden die chronische infecties veroorzaken
- Dolfijnen slaan mensen, chimpansees bij vroege tekenen van zelfbewustzijn
- Hernieuwde oproepen voor legale jacht om de groeiende berenpopulatie in Connecticuts onder controle te houden
- Maïsplaag maakt gebruik van plantafweerstoffen om zichzelf te beschermen
- Perfect gedoteerde kwantumstippen leveren kleuren om voor te verven

- Extra zwavel verbetert de elektronische structuur van kwantumstippen

- Gouden nanodeeltjesketens beperken licht tot nanoschaal
- Wetenschappers ontwerpen 3D-gegroeid materiaal dat de productie van nieuwe technologieën voor slimme gebouwen en robotica zou kunnen versnellen

- Elektronische oscillaties in grafeen kunnen een tafelbladbron van röntgenstralen een realiteit maken

 Hoe Extruder-doorvoer te berekenen
Hoe Extruder-doorvoer te berekenen  Arme mensen ervaren meer financiële problemen in gebieden waar de inkomensongelijkheid het grootst is
Arme mensen ervaren meer financiële problemen in gebieden waar de inkomensongelijkheid het grootst is Verschil tussen optische dichtheid en absorptie
Verschil tussen optische dichtheid en absorptie Zandboerderijen in Tunesië zijn bestand tegen droogte, ontwikkeling
Zandboerderijen in Tunesië zijn bestand tegen droogte, ontwikkeling Vrouwen riskeren grijs haar om zich authentiek te voelen
Vrouwen riskeren grijs haar om zich authentiek te voelen Giftige algenbloei wordt erger, maar overzicht ontbreekt
Giftige algenbloei wordt erger, maar overzicht ontbreekt Welvaart doodt de planeet, waarschuw wetenschappers
Welvaart doodt de planeet, waarschuw wetenschappers Afbeelding:Columbus-module op schaal
Afbeelding:Columbus-module op schaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

