Wetenschap
Nieuwe nanoscopische hulpmiddelen om ligandbinding van receptoren te bestuderen en twee ligandbindingsplaatsen te kwantificeren
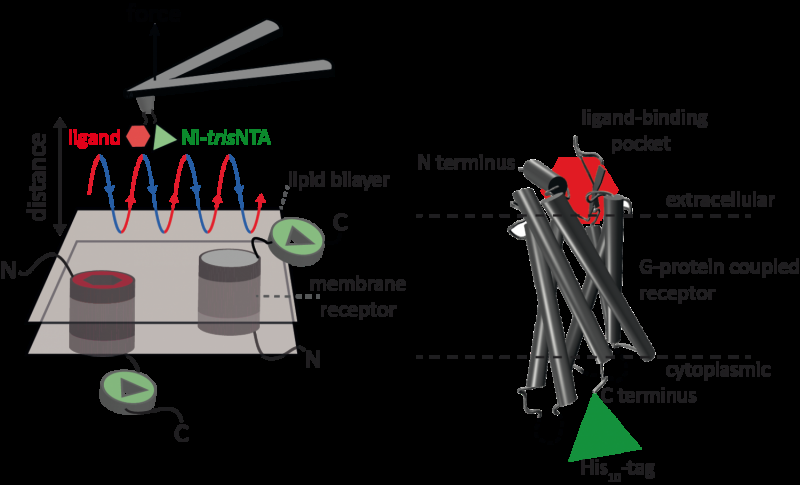
Een nieuwe methode met hoge resolutie, ontwikkeld door een internationaal team van wetenschappers, waaronder Robert Tampé en Ralph Wieneke van de Goethe Universiteit Frankfurt, maakt nu voor het eerst nauwkeurige identificatie en kwantificering van interacties van een receptor met twee liganden tegelijk mogelijk. Krediet:GU
Signaalprocessen in organismen worden bepaald door specifieke extracellulaire en intracellulaire interacties en omvatten honderden verschillende functioneel zeer veelzijdige receptoren die zich in celmembranen bevinden. Voor wetenschappers die signaalprocessen willen begrijpen, wordt de situatie ingewikkelder doordat de receptoren niet alleen ongelijk verdeeld zijn en vaak in staat zijn om meer dan één ligand te binden, maar ook doordat hetzelfde type receptor in staat is om een ligand sterk te binden, zwak of niet allemaal. Er is dringend behoefte aan nieuwe methoden die nauwkeurige kwantificering van dergelijke complexe interacties mogelijk maken.
Een nieuwe methode met hoge resolutie, ontwikkeld door een internationaal team van wetenschappers, waaronder Robert Tampé en Ralph Wieneke van de Goethe Universiteit Frankfurt, maakt nu voor het eerst nauwkeurige identificatie en kwantificering van interacties van een receptor met twee liganden tegelijk mogelijk. De nieuwe methode is gepubliceerd in de nieuwste editie van het tijdschrift Natuurcommunicatie .
Atoomkrachtmicroscopie (AFM) is een krachtige techniek voor het karakteriseren van oppervlakken op nanoschaal. Het maakt gebruik van een cantilever met een extreem fijne punt. Kracht-afstand-curve-gebaseerde atomic force microscopie (FD-gebaseerde AFM) combineert beeldvorming met hoge resolutie en krachtspectroscopie met één molecuul. In onderzoeken met biologische monsters, de AFM-tip nadert en trekt zich terug uit het monster voor elke pixel. Op FD gebaseerde AFM-methoden gebruiken verschillende coatings van de AFM-tip als gereedschapskist en dergelijke methoden hebben de afgelopen jaren indrukwekkende vooruitgang geboekt. Voor de detectie van specifieke bindingsplaatsen is op FD gebaseerde AFM het vastbinden van een ligand aan de AFM-tip vereist. Bij het contouren van eiwitcomplexen in een membraan kunnen dergelijke gefunctionaliseerde AFM-tips vervolgens de interacties van het gebonden ligand met het eiwit meten. Het was niet mogelijk geweest om enkele membraanreceptoren in beeld te brengen en tegelijkertijd hun interacties met meer dan één ligand te detecteren, maar de nieuwe methode heeft deze hindernis overwonnen.
Voor hun proof of principle gebruikten de wetenschappers de humane protease-activated receptor 1 (PAR1), een van de grote familie van aan G-eiwit gekoppelde membraanreceptoren. GPCR's mediëren de meeste cellulaire reacties op hormonen en neurotransmitters, naast verantwoordelijk voor het gezichtsvermogen, reuk en smaak. GPCR's kunnen naast elkaar bestaan in verschillende functionele toestanden in het celmembraan en kunnen verschillende liganden binden met verschillende sterkte of affiniteit. De GPCR PAR1 wordt geactiveerd door het stollingsprotease trombine dat signaalcascades triggert om cellulaire reacties te initiëren die hemostase helpen orkestreren, trombose, ontsteking en mogelijk ook weefselherstel. Met behulp van hun nieuwe FD-gebaseerde AFM-methode kon menselijk PAR1 in proteoliposomen worden afgebeeld terwijl tegelijkertijd extracellulaire en intracellulaire interacties van PAR1 met twee liganden werden gedetecteerd. De ontwikkelde oppervlaktechemie en nanoscopische methode zijn toepasbaar op een reeks biologische systemen in vitro en in vivo.
Hoofdlijnen
- Het weer in november is een lastige tijd voor schildpadden
- Uitsterven dreigt voor twee zeldzame vogelsoorten na verwoestende orkanen
- Kenmerken van Twins
- Commensalisme:ik profiteer,
- Wat zijn de chemische zintuigen?
- De rol van GTE in DNA-extractie
- Onderzoekers verwachten dat nieuwe vispassage de trekvispopulaties zal herstellen
- Waarom zijn de roze meren van Australië roze?
- We kregen te maken met misbruik omdat we mensen vroegen om wespen te doden voor de wetenschap - hier is waarom het de moeite waard was
 De lonen van boeren moeten worden verbeterd om te voorkomen dat miljoenen in India ondervoed raken
De lonen van boeren moeten worden verbeterd om te voorkomen dat miljoenen in India ondervoed raken Opgraven van het precambrium - fossiele holen tonen vroege oorsprong van dierlijk gedrag
Opgraven van het precambrium - fossiele holen tonen vroege oorsprong van dierlijk gedrag Wat gebeurt er met niet-polaire moleculen in water?
Wat gebeurt er met niet-polaire moleculen in water?  Video:ESA's meteorencamera legt de Perseïdenregen vast
Video:ESA's meteorencamera legt de Perseïdenregen vast Onderzoekers stellen een raamwerk voor voor het evalueren van de effecten van klimaatverandering op de water- en energiesystemen van Californië
Onderzoekers stellen een raamwerk voor voor het evalueren van de effecten van klimaatverandering op de water- en energiesystemen van Californië Hoe te verpakken om een ei te beschermen voor een wetenschapsproject?
Hoe te verpakken om een ei te beschermen voor een wetenschapsproject?  Robots die met 3D-printers zijn gemaakt, kunnen voor degenen in gouden jaren zorgen
Robots die met 3D-printers zijn gemaakt, kunnen voor degenen in gouden jaren zorgen Stagiaire planetaire wetenschap leidt onderzoek naar Marskorst
Stagiaire planetaire wetenschap leidt onderzoek naar Marskorst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com