
Wetenschap
Een biologische escape room:natuurkundigen krijgen van buiten een glimp van eiwitaggregaten die diabetes veroorzaken
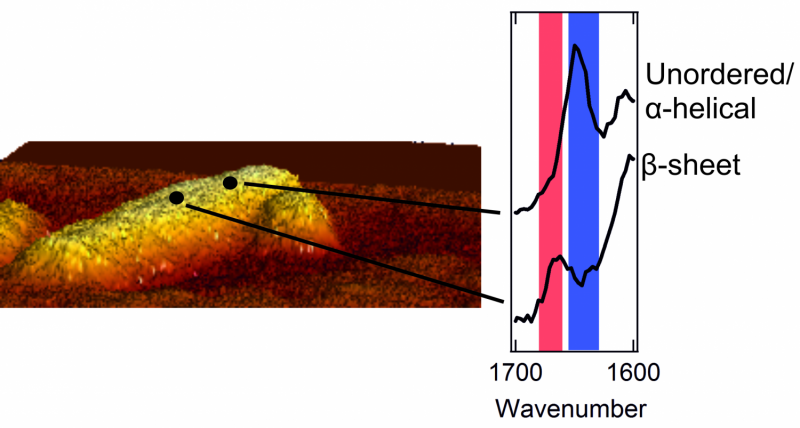
Links:een atoomkrachtmicroscoopopname van een fibril met een diameter van enkele nanometers. Rechts:twee spectra die de buitenstructuur laten zien. Een piek in het rode gebied is kenmerkend voor een patch met een netjes geordende bèta-sheetstructuur. Een piek in het blauwe gebied is typerend voor een gebied met een chaotische, rommelige structuur.
Onderzoekers van FOM-instituut AMOLF hebben, voor de eerste keer ooit, slaagde erin een beeld te maken van de uitwendige structuur van een eiwitaggregaat dat ziekten als Alzheimer en diabetes type 2 veroorzaakt. Ze ontdekten dat het buitenoppervlak van deze aggregaten op een zeer rommelige manier is gestructureerd - veel in tegenstelling tot hun netjes gerangschikte interieurs. De onderzoekers hopen dat hun werk meer inzicht zal geven in de manier waarop de aggregaten nabijgelegen cellen beschadigen. De onderzoeksresultaten werden online gepubliceerd in het tijdschrift Klein op 7 mei, 2015.
De door de onderzoekers bestudeerde eiwitaggregaten bestaan uit lange, gevouwen eiwitten. Onderzoekers zijn al geruime tijd bekend met de inwendige structuur van deze aggregaten (formeel bekend als amyloïde fibrillen). Echter, met conventionele microscopen bleef het altijd onmogelijk om de eiwitstructuren aan het buitenoppervlak van de aggregaten te zien. Achteraf gezien, het was alsof de onderzoekers in een huis waren opgesloten. Ze konden het interieur van het huis grondig bestuderen, maar zolang ze de sleutel niet hadden, ze waren niet in staat om uit te stappen en naar de gevel aan de buitenkant te kijken. De doorbraak kwam toen de onderzoekers die 'sleutel' bedachten door twee verschillende technieken te combineren:microscopie en spectroscopie. Zo konden ze eindelijk het 'metselwerk' aan de buitenkant bestuderen.
Rommelig
Zodra ze een glimp van de buitenkant van de eiwitaggregaten konden opvangen, de onderzoekers stonden voor een verrassing. Het interieur van de aggregaten is strikt georganiseerd. De eiwitten zijn netjes gerangschikt in een zogenaamde beta-sheetstructuur, die een gedraaide, geplooid blad. Echter, ze ontdekten dat de buitenkant van het aggregaat een veel rommeligere en chaotischere structuur heeft. Dat is, de uitwendige eiwitten vormen een ongeorganiseerd, onregelmatig patroon. Hier en daar, er zijn patches die een bètabladstructuur vormen, maar op andere plaatsen is deze regelmaat nergens terug te vinden. De onderzoekers vonden zelfs structurele verschillen van nanometer tot nanometer, op één en dezelfde fibril.
De onderzoekers merkten ook op dat de uitwendige structuur van elke fibril heel anders is dan de volgende. Eén fibril kan veel pleisters bevatten met een bètabladstructuur, terwijl een ander deze reguliere patches bijna volledig mist. Bovendien, ook de aminozuren die aan de buitenkant te vinden zijn, verschillen per fibril.
De rommelige buitenkant staat in direct contact met de membranen van aangrenzende cellen. Op deze manier, de structuur ervan speelt een cruciale rol bij het beschadigen van deze cellen. Dit type celbeschadiging komt vaak voor bij patiënten met diabetes type 2 of de ziekte van Alzheimer.
De 'sleutel' die de deuren opende
De AMOLF-onderzoekers werkten samen met hun collega's van de Universiteit Utrecht, het Max Planck Instituut voor Polymeeronderzoek in Mainz, en het Leibniz Institute for Photonic Technology in Jena om een nieuwe manier te ontwikkelen om de eiwitstructuur van de buitenkant van de aggregaten te bekijken. De sleutel bleek een combinatie van spectroscopie en atoomkrachtmicroscopie.
Een atoomkrachtmicroscoop bestaat uit een scherpe punt (sonde) die over het oppervlak van een object beweegt. Hierdoor kan de microscoop een amyloïde fibril op atomaire schaal onderzoeken en een reliëfkaart maken. In de tussentijd, de spectrometer meet het zogenaamde Raman-spectrum voor elke pixel van de kaart. Deze spectra geven informatie over de manier waarop de eiwitten worden gevouwen, en de aanwezigheid van specifieke aminozuren op het oppervlak van de aggregaten. De door de spectrometer gemeten signalen zijn meestal zwak, maar een metalen laag op de punt van de microscoop versterkt ze enorm.
Beelden van de buitenkant van de amyloïde fibrillen waren al eerder gemaakt, maar het team beeldde zich nu ook de manier af waarop de eiwitten werden gevouwen. Eerste auteur Corianne van den Akker:"Door microscopie en spectroscopie te combineren, we zijn erin geslaagd om elk stukje structuur te koppelen aan een locatie aan de buitenkant van de amyloïde. Op deze manier, we zouden een foto kunnen maken met een resolutie op nanoschaal, en bepalen de structuur op elke locatie. Dat is het unieke van de techniek die we hebben gebruikt."
De volgende stap
Met de nieuw opgedane kennis, de structuur van amyloïden die zich aan de buitenkant van levende cellen hebben gevormd, zal ook kunnen worden gemeten. De techniek kan ook worden gebruikt om medicijnen te testen die gericht zijn op het voorkomen of oplossen van eiwitaggregaten.
 Het delen van gegevens is de toekomst van materiaalonderzoek
Het delen van gegevens is de toekomst van materiaalonderzoek Eiwitporiën verpakt in polymeren maken superefficiënte filtratiemembranen
Eiwitporiën verpakt in polymeren maken superefficiënte filtratiemembranen Vanadiumafhankelijke stikstofase kan twee CO-moleculen tegelijk binden
Vanadiumafhankelijke stikstofase kan twee CO-moleculen tegelijk binden Wetenschappers ontrafelen synthetisch mechanisme van arylpentazol en substituenteffect
Wetenschappers ontrafelen synthetisch mechanisme van arylpentazol en substituenteffect Stabiliserende eigenschappen van vurengom kunnen worden aangepast met behulp van extractietechnieken
Stabiliserende eigenschappen van vurengom kunnen worden aangepast met behulp van extractietechnieken
 Hoe beïnvloedt de gemeentelijke afvalinzameling de klimaatverandering?
Hoe beïnvloedt de gemeentelijke afvalinzameling de klimaatverandering? Hawaiiaanse eilanden vermijden voltreffer van orkaan Douglas
Hawaiiaanse eilanden vermijden voltreffer van orkaan Douglas Poetin zegt dat klimaatverandering niet wordt veroorzaakt door uitstoot
Poetin zegt dat klimaatverandering niet wordt veroorzaakt door uitstoot Aardbeving biedt nieuwe kansen voor onderzoek, Directeur geologisch onderzoek Idaho zegt:
Aardbeving biedt nieuwe kansen voor onderzoek, Directeur geologisch onderzoek Idaho zegt: Team gebruikt een innovatieve netwerkbenadering om veelhoekige patronen in wolken te verklaren
Team gebruikt een innovatieve netwerkbenadering om veelhoekige patronen in wolken te verklaren
Hoofdlijnen
- Kunstmatige selectie (selectieve fokkerij): definitie & voorbeelden
- Hernieuwde oproepen voor legale jacht om de groeiende berenpopulatie in Connecticuts onder controle te houden
- Het verschil tussen een sporofyt en gametofyt
- Onderzoek naar het verleden van aardappelen kan de spuds van de toekomst verbeteren
- Sommige mariene soorten zijn kwetsbaarder voor klimaatverandering dan andere
- Hoe de cellen van planten, dieren en eencellige organismen te vergelijken
- Australische soorten hebben een onafhankelijke kampioen nodig
- Hoe de immuunrespons bijdraagt aan Homeostasis
- Forest Service weegt wijzigingen in bescherming voor saliehoen af
- Onderzoekers ontdekken dat vreemde nieuwe nanoregio's zich kunnen vormen in quasikristallen

- Magneten overtreffen metalen:magnetische velden kunnen de geleidbaarheid van koolstofnanobuisjes blokkeren

- Beter leven door druk - functionele nanomaterialen gemakkelijk gemaakt

- Kleine aquaria tonen zelfassemblage van nanodeeltjes

- Gevoelige sensor detecteert DNA syndroom van Down

 Wat zijn enkele chemische reacties die worden gebruikt bij de productie van papier?
Wat zijn enkele chemische reacties die worden gebruikt bij de productie van papier?  Groene en eetbare huishoudfolie en voedselverpakkingen gemaakt van planten
Groene en eetbare huishoudfolie en voedselverpakkingen gemaakt van planten Klimaatberekeningen op lange termijn verbeteren
Klimaatberekeningen op lange termijn verbeteren Voor sommige stedelijke gebieden is een opwarmend klimaat is slechts de helft van de bedreiging
Voor sommige stedelijke gebieden is een opwarmend klimaat is slechts de helft van de bedreiging Tijdens transitvertragingen,
Tijdens transitvertragingen,  United wil dat passagiers geld doneren aan duurzame vliegtuigbrandstof. Is het beter dan CO2-compensaties om de planeet te redden?
United wil dat passagiers geld doneren aan duurzame vliegtuigbrandstof. Is het beter dan CO2-compensaties om de planeet te redden? Inheems landgebruik verminderde catastrofale bosbranden op het Fish Lake Plateau
Inheems landgebruik verminderde catastrofale bosbranden op het Fish Lake Plateau Labstudie roept vragen op over de impact van nanodeeltjes
Labstudie roept vragen op over de impact van nanodeeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

