
Wetenschap
Spanningstester voor het kloppen van hartcellen

Wetenschappers zijn erin geslaagd de elektrische potentiaal over het membraan van samentrekkende hartcellen te registreren (symbool). Credit:Keystone / Science Photo Library / Beermedia / Fotolia / Montage
Voor de eerste keer, wetenschappers zijn erin geslaagd de stroom in membraankanalen van samentrekkende hartcellen te registreren. Om dit te doen, de wetenschappers combineerden een atoomkrachtmicroscoop met een veelgebruikte methode voor het meten van elektrische signalen in cellen.
Elektrische impulsen spelen een belangrijke rol in cellen van het menselijk lichaam. Bijvoorbeeld, neuronen gebruiken deze impulsen om informatie langs hun takken te verzenden en het lichaam gebruikt ze ook om de samentrekking van spieren te regelen. De impulsen worden gegenereerd wanneer speciale kanaaleiwitten zich openen in de buitenste envelop van de cellen, waardoor geladen moleculen (ionen) de cel kunnen binnenkomen of verlaten. Deze eiwitten worden ionkanalen genoemd. Sinds de jaren zeventig, voor onderzoekers een methode beschikbaar is waarmee de activiteit van deze kanalen kan worden gemeten, maar tot nu toe is deze methode voornamelijk gebruikt op cellen die niet bewegen. Elektrotechnici van ETH Zürich en biologen van de Universiteit van Bern hebben de methode nu verder ontwikkeld, zodat ze gemakkelijk de activiteit van bewegende cellen kunnen registreren, zoals het slaan van hartspiercellen in een weefselkweekschaal.
De bestaande methode houdt in dat een glazen pipet tegen het buitenmembraan van een cel wordt geplaatst. De opening aan de punt van de pipet is zo klein dat deze slechts een fractie van het celoppervlak raakt. Ideaal, dit kleine stukje celmembraan heeft precies één ionkanaal. De binnenkant van de pipet is gevuld met een geleidende vloeistof en een elektrode, waarmee het mogelijk is om verschillen in de lading tussen het buitenste deel van de cel en het celinterieur (d.w.z. een elektrische potentiaal) en tijdelijke veranderingen in deze potentiaal als gevolg van activiteit in de ionenkanalen te meten. De methode wordt de patch-clamp-techniek genoemd omdat de pipet wordt gebruikt om een patch van het celmembraan vast te klemmen.
Atoomkrachtmicroscoop met micro-injectienaald
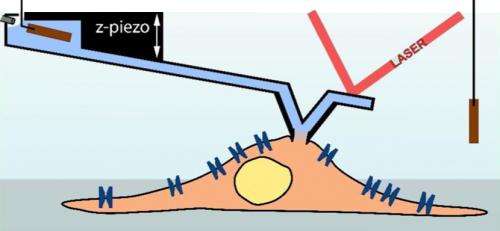
Een atomic force microscoop opname naald (lichtblauw) dient als pipet om een cel te meten (lichtbruin; schema). (Illustratie:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) Een opnamenaald van een atoomkrachtmicroscoop (lichtblauw) dient als een pipet om een cel te meten (lichtbruin; schema). Krediet:Ossola D et al. Nanobrieven 2015 / Copyright American Chemical Society
Onder leiding van Tomaso Zambelli, een docent aan het Institute of Biomedical Engineering aan de ETH Zürich, en Hugues Abriël, een professor aan de afdeling Klinisch Onderzoek van de Universiteit van Bern, de onderzoekers hebben deze techniek nu gecombineerd met een atomic force microscoop. Een sensortip zit op een beweegbare houder - een zogenaamde cantilever - om het oppervlak van het microscopische object te scannen. Een aantal jaar geleden, de onderzoekers zijn erin geslaagd om sensortips te maken met een intern kanaal, waarmee de computergestuurde injectie van moleculen in een cel mogelijk is. Deze techniek wordt nu op de markt gebracht door de ETH-spin-off Cytosurge. Echter, de wetenschappers zetten de ontwikkeling van deze techniek voort door de micro-injectienaald te voorzien van een elektrode om patch-clamp-metingen uit te voeren. De onderzoekers hebben de succesvolle resultaten van deze onderneming nu gepubliceerd in het tijdschrift Nano-letters .
De patch-clamp-techniek is niet alleen een centrale methode voor fundamenteel onderzoek in de celbiologie, het wordt ook routinematig gebruikt bij de ontwikkeling van nieuwe medicijnen. Bijvoorbeeld, de farmaceutische industrie is wettelijk verplicht om als onderdeel van het goedkeuringsproces voor nieuwe medicijnen te testen of deze medicijnen interageren met ionkanalen. Een geneesmiddel dat ionkanalen blokkeert, kan ernstige hartritmestoornissen veroorzaken bij patiënten, die koste wat kost vermeden moeten worden.
Langere metingen en automatisering mogelijk
In het geval van de conventionele patch-clamp-techniek, een operator plaatst de pipet handmatig tegen de cel; hoewel er geautomatiseerde procedures bestaan, hun toepassingen zijn beperkt. Dus, de te testen cellen moeten dezelfde grootte en vorm hebben en mogen niet bewegen (zoals hartcellen doen).
In het geval van de nieuwe methode de micronaald wordt bestuurd door een computer met behulp van krachtmetingen van de atoomkrachtmicroscoop om deze op een constante korte afstand van het celoppervlak te houden. "Dit maakt het contact tussen naald en cel veel stabieler, waarmee we over een langere periode kunnen meten en zelfs bewegende cellen kunnen testen, " legt Zambelli uit. Voor de eerste keer, onderzoekers zijn er dus in geslaagd elektrische potentiaalveranderingen in de ionenkanalen van kloppende hartcellen te meten. Zambelli zegt dat hij zich dit ook kan voorstellen als basis voor de ontwikkeling van een geautomatiseerde methode voor het testen van elke cel, ongeacht de vorm of grootte.
 Neutronen bieden de eerste blik op een levend celmembraan op nanoschaal
Neutronen bieden de eerste blik op een levend celmembraan op nanoschaal Verandert zout de pH van water?
Verandert zout de pH van water?  Faseovergangen leiden tot nieuwe geavanceerde materialen
Faseovergangen leiden tot nieuwe geavanceerde materialen Ontgrendelen van efficiënte licht-energieconversie met stabiele coördinatie-nanobladen
Ontgrendelen van efficiënte licht-energieconversie met stabiele coördinatie-nanobladen Eenvoudige watertest kan verlammende botziekte voorkomen
Eenvoudige watertest kan verlammende botziekte voorkomen
 Nieuw onderzoek naar klimaatverandering:aantal mensen met extreme droogte zal verdubbelen
Nieuw onderzoek naar klimaatverandering:aantal mensen met extreme droogte zal verdubbelen Hoe uw regenton te verbergen
Hoe uw regenton te verbergen  Egg Parachute Design Instructions
Egg Parachute Design Instructions IJzerrijke meteorieten tonen een record van kernkristallisatie in de oudste planetesimalen van systemen
IJzerrijke meteorieten tonen een record van kernkristallisatie in de oudste planetesimalen van systemen Extreme droogte in Brazilië veroorzaakt dodelijke zandstormen
Extreme droogte in Brazilië veroorzaakt dodelijke zandstormen
Hoofdlijnen
- Het verschil tussen histon en nonhistone
- Hoe meet je geluk?
- De toekomst van gewastechniek
- Zes soorten neuroglia
- Walviskarkas opgegraven van Australisch strand vanwege angst voor haaien
- Waar bevindt het DNA zich in een cel?
- Wat is de volgorde van de gebeurtenissen in de bevruchting van een ei?
- Jacht op herten beperkt in westelijke Amerikaanse staten na strenge winter
- De voordelen van het gebruik van Sticky End Enzymen
- Nanodeeltjes verlichte symptomen van inflammatoire darmziekte bij muizen

- Nanostructuren gemodelleerd naar mottenogen, effectief voor anti-ijsvorming
- Optische geheimen van disulfide nanobuisjes worden onthuld
- Grafeen-biosensor kan vroege diagnose van longkanker bieden, uit onderzoek blijkt

- Symptomen allemaal in je hoofd - of in je buik? Misschien een beetje van beide.
 Grieppandemieën in de kiem smoren
Grieppandemieën in de kiem smoren Wetenschappers vinden bewijs van ontbrekende neutronenster
Wetenschappers vinden bewijs van ontbrekende neutronenster De verschillen tussen fretten en wezels
De verschillen tussen fretten en wezels  Wanneer is een krokodil geen krokodil? Wanneer het een thoracosaurus is
Wanneer is een krokodil geen krokodil? Wanneer het een thoracosaurus is Onderzoekers ontwikkelen tool voor snelle diagnose van bacteriële infecties
Onderzoekers ontwikkelen tool voor snelle diagnose van bacteriële infecties Een legering die zijn geheugen behoudt bij hoge temperaturen
Een legering die zijn geheugen behoudt bij hoge temperaturen Duizenden evacueren omdat Sydney de ergste overstromingen in decennia ziet
Duizenden evacueren omdat Sydney de ergste overstromingen in decennia ziet Biomarker van de volgende generatie detecteert tumorcellen en levert geneesmiddelen tegen kanker
Biomarker van de volgende generatie detecteert tumorcellen en levert geneesmiddelen tegen kanker
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

