
Wetenschap
Was, zeep ruim obstakels op voor betere batterijen

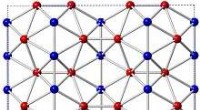
Deze kleine vlokken lithium-mangaanfosfaat kunnen dienen als elektroden voor batterijen. Een nieuwe methode maakt gebruik van was en zeep om hoogwaardige materialen te vormen. De eenstapsmethode stelt batterijontwikkelaars in staat om goedkopere alternatieven te verkennen voor de oplaadbare lithium-ionbatterijen die momenteel op de markt zijn. Krediet:Daiwon Choi, PNNL
Een beetje was en zeep kunnen helpen bij het bouwen van elektroden voor goedkopere lithium-ionbatterijen, volgens een studie in de uitgave van 11 augustus van Nano-letters . De eenstapsmethode stelt batterijontwikkelaars in staat om goedkopere alternatieven te verkennen voor de lithium-ion-metaaloxidebatterijen die momenteel op de markt zijn.
"Paraffine biedt een medium om goede elektrodematerialen in te kweken, "zei materiaalwetenschapper Daiwon Choi van het Pacific Northwest National Laboratory van het Department of Energy. "Deze methode zal onderzoekers helpen bij het onderzoeken van kathodematerialen op basis van goedkopere overgangsmetalen zoals mangaan of ijzer."
Consumenten gebruiken oplaadbare lithium-ionbatterijen met een lange levensduur in alles, van mobiele telefoons tot de nieuwste draagbare gadgets. Sommige autofabrikanten willen ze in voertuigen gebruiken. De meeste lithium-ionbatterijen die tegenwoordig verkrijgbaar zijn, zijn ontworpen met een oxide van metaal zoals kobalt, nikkel, of mangaan. Choi en collega's van PNNL en State University of New York in Binghamton wilden zowel goedkopere metalen als het stabielere fosfaat in plaats van oxide onderzoeken.
Het oplaadverhaal
Deze oplaadbare batterijen werken omdat lithium egoïstisch is en zijn eigen elektron wil. Positief geladen lithiumionen hangen normaal gesproken rond in metaaloxide, de stal, positieve elektrode in batterijen. Metaaloxide deelt royaal zijn elektronen met de lithiumionen.
Opladen met elektriciteit pompt elektronen in de negatieve elektrode, en wanneer de lithiumionen de vrij zwevende negatieve ladingen over de batterij zien, ze worden aangetrokken tot het leven weg van de metaaloxide kooi. Dus uit de lithium-ionen gaan, het metaaloxide en zijn gedeelde elektronen verlaten om tijd door te brengen met genieten van hun eigen privé-elektronen.
Maar de affaire houdt geen stand:door de batterij in een elektronisch apparaat te gebruiken, ontstaat er een kanaal waardoor de glibberige elektronen kunnen stromen. Hun elektronen verliezen, de lithiumionen slinken terug naar het altijd wachtende metaaloxide. Het opladen begint het hele smerige proces opnieuw.
Goedkoper, Stabieler
Hoewel kobaltoxide goed presteert in lithiumbatterijen, kobalt en nikkel zijn duurder dan mangaan of ijzer. In aanvulling, het vervangen van fosfaat door oxide zorgt voor een stabielere structuur voor lithium.
Lithium-ijzerfosfaatbatterijen zijn in de handel verkrijgbaar in sommige elektrische gereedschappen en zonneproducten, maar de synthese van het elektrodemateriaal is gecompliceerd. Choi en collega's wilden een eenvoudige methode ontwikkelen om lithiummetaalfosfaat om te zetten in een goede elektrode.
Lithium-mangaanfosfaat -- LMP -- kan theoretisch enkele van de grootste hoeveelheden energie van de oplaadbare batterijen opslaan, met een gewicht van 171 milliAmp-uur per gram materiaal. Door de hoge opslagcapaciteit zijn de batterijen licht. Maar andere onderzoekers die met LMP werken, hebben tot nu toe niet eens 120 milliAmp-uur per gram kunnen halen uit het materiaal dat ze hebben gesynthetiseerd.
Choi redeneerde dat het capaciteitsverlies van 30 procent te wijten zou kunnen zijn aan lithium en elektronen die zich een weg moeten banen door het metaaloxide, een eigenschap die weerstand wordt genoemd. Hoe minder afstand lithium en elektronen uit de kathode moeten reizen, hij dacht, hoe minder weerstand en hoe meer elektriciteit er kan worden opgeslagen. Een kleiner deeltje zou die afstand verkleinen.
Maar het kweken van kleinere deeltjes vereist lagere temperaturen. Helaas, lagere temperaturen betekenen dat de metaaloxidemoleculen niet goed op één lijn liggen in de kristallen. Willekeur is niet geschikt voor kathodematerialen, dus de onderzoekers hadden een raamwerk nodig waarin de ingrediënten - lithium, mangaan en fosfaat -- zouden zichzelf kunnen rangschikken in nette kristallen.
In de was zetten, Was uit
Paraffinewas bestaat uit lange rechte moleculen die niet reageren met veel, en de lange moleculen kunnen helpen om dingen op een rij te krijgen. Zeep - een oppervlakteactieve stof genaamd oliezuur - kan de groeiende kristallen helpen gelijkmatig te verspreiden.
Dus, Choi en collega's mengden de elektrode-ingrediënten met gesmolten paraffine en oliezuur en lieten de kristallen groeien terwijl ze de temperatuur langzaam verhoogden. Bij 400 Celsius (vier keer de temperatuur van kokend water), er waren kristallen gevormd en de was en zeep waren afgekookt. Materiaalwetenschappers versterken metalen over het algemeen door ze aan hoge temperaturen te onderwerpen, dus het team verhoogde de temperatuur nog meer om de kristallen in een plaat te laten smelten.
"Deze methode is een stuk eenvoudiger dan andere manieren om lithium-mangaanfosfaatkathoden te maken, " zei Choi. "Andere groepen hebben een gecompliceerde, proces met meerdere stappen. We mengen alle componenten en warmen het op."
Om de grootte van de minuscule platen te meten, het team gebruikte een transmissie-elektronenmicroscoop in EMSL, DOE's Environmental Molecular Sciences Laboratory op de PNNL-campus. Dichtbij, klein, dunne rechthoeken staken alle kanten op. De nanoplaten waren ongeveer 50 nanometer dik - ongeveer duizend keer dunner dan een mensenhaar - en tot 2000 nanometer aan een kant. Andere analyses toonden aan dat de kristalgroei geschikt was voor elektroden.
Om LMP te testen, het team schudde de nanoplaten van elkaar en voegde een geleidende koolstofrug toe, die dient als de positieve elektrode. Het team testte hoeveel elektriciteit het materiaal kon opslaan na snel of langzaam opladen en ontladen.
Toen de onderzoekers de nanoplaten gedurende een dag langzaam oplaadden en weer net zo langzaam ontlaadden, de LMP-minibatterij hield iets meer dan 150 milliAmp-uur per gram materiaal vast, hoger dan andere onderzoekers hadden kunnen bereiken. Maar toen de batterij snel leeg was - zeg, binnen een uur, dat daalde tot ongeveer 117, vergelijkbaar met ander materiaal.
Zijn beste prestatie klopte op het theoretische maximum van 168 milliAmp-uur per gram, wanneer het gedurende twee dagen langzaam werd opgeladen en ontladen. Opladen en ontladen in een uur - een redelijk doel voor gebruik in consumentenelektronica - zorgde ervoor dat het een magere 54 milliAmp-uur per gram kon opslaan.
Hoewel deze versie van een LMP-batterij langzamer oplaadt dan andere kathodematerialen, Choi zei dat het echte voordeel van dit werk is dat het gemakkelijke, Dankzij de eenstapsmethode kunnen ze een breed scala aan goedkope materialen verkennen waarmee traditioneel moeilijk te werken was bij de ontwikkeling van oplaadbare lithium-ionbatterijen.
In de toekomst, het team zal veranderen hoe ze de koolstofcoating op de LMP-nanoplaten opnemen, die hun laad- en ontlaadsnelheden zouden kunnen verbeteren.
Hoofdlijnen
- De krimpende eland van Isle Royale
- Explosie van ratten, klaverblaadjes, bedmijt, muggen onbedoeld evolutionair gevolg van verstedelijking
- Klimaatverandering maakt baardagamen mogelijk minder intelligent
- Microevolution vs Macroevolution: Similiarities & Differences
- Eerste Amerikaanse vrouw bevalt van getransplanteerde baarmoeder
- Wat levert elektronen voor de lichtreacties?
- Inzoomen op eiwit om nierstenen te voorkomen
- Slangenmans gifgewoonte houdt hoop op nieuw tegengif
- Wat zijn sommige Cell Organelle-analogieën?
- Nieuwe goedkope techniek zet bulklegeringen om in oxide-nanodraden

- Publiek wil labels voor voedselnanotech - en ze zijn bereid ervoor te betalen

- Grafeenballonnen om edelgassen te identificeren

- Borium krijgt nano-update:wetenschappers vinden stabiele 2D-structuren met unieke eigenschappen
- Kleine DNA-benen lopen met een record brandstofverbruik
 Online bijles verbetert de prestaties en het welzijn van achtergestelde scholieren in lockdown
Online bijles verbetert de prestaties en het welzijn van achtergestelde scholieren in lockdown Het lanceren van fusiereacties zonder een centrale magneet, of solenoïde
Het lanceren van fusiereacties zonder een centrale magneet, of solenoïde  Geen hondenleven voor oudere dieren in Singapore Zoo
Geen hondenleven voor oudere dieren in Singapore Zoo Hoe Crash Forces berekenen
Hoe Crash Forces berekenen Dodental cycloon Zuid-Azië passeert 100
Dodental cycloon Zuid-Azië passeert 100 Migratiegegevens gebruiken om marketingstrategieën voor Indiase plattelandsgemeenschappen te verfijnen
Migratiegegevens gebruiken om marketingstrategieën voor Indiase plattelandsgemeenschappen te verfijnen Nanodeeltjes van koperjodide effectief tegen het pandemische H1N1-influenzavirus van 2009
Nanodeeltjes van koperjodide effectief tegen het pandemische H1N1-influenzavirus van 2009 Berekening van discrete returns
Berekening van discrete returns
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


