
Wetenschap
Nanosponge-medicijnafgiftesysteem effectiever dan directe injectie
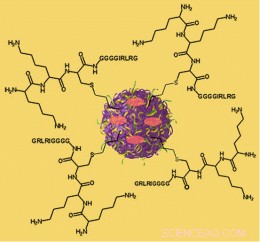
Illustratie van een nanosponsdeeltje. De rode ovalen vertegenwoordigen de medicijnlading die het vervoert en de peptiden die aan het oppervlak zijn bevestigd en het deeltje met het oppervlak van een tumor verbinden, worden weergegeven in chemische notatie.
(PhysOrg.com) -- Wanneer geladen met een geneesmiddel tegen kanker, een toedieningssysteem op basis van een nieuw materiaal genaamd nanospons is drie tot vijf keer effectiever in het verminderen van tumorgroei dan directe injectie.
Dat is de conclusie van een paper gepubliceerd in het nummer van 1 juni van het tijdschrift Kankeronderzoek .
"Effectieve gerichte medicijnafgiftesystemen zijn al lang een droom, maar het is grotendeels gefrustreerd door de complexe chemie die erbij betrokken is, " zegt Eva Hart, assistent-professor scheikunde bij Vanderbilt, die het nanospons-afgiftesysteem heeft ontwikkeld. "We hebben een belangrijke stap gezet in de richting van het overwinnen van deze obstakels."
De studie was een samenwerking tussen het laboratorium van Harth en dat van Dennis E. Hallahan, een voormalig hoogleraar stralingsoncologie aan Vanderbilt die nu aan de Washington University School of Medicine zit. Corresponderende auteurs zijn Harth en Roberto Diaz van Emory University, die in het Hallahan-laboratorium werkte toen de onderzoeken werden gedaan.
Om het leveringssysteem van Hart te visualiseren, stel je voor dat je kleine sponzen maakt die ongeveer zo groot zijn als een virus, ze vullen met een medicijn en speciale chemische "linkers" bevestigen die zich bij voorkeur hechten aan een kenmerk dat alleen op het oppervlak van tumorcellen wordt gevonden en ze vervolgens in het lichaam injecteren. De kleine sponzen circuleren door het lichaam totdat ze het oppervlak van een tumorcel tegenkomen, waar ze aan het oppervlak blijven plakken (of de cel in worden gezogen) en beginnen hun krachtige lading op een controleerbare en voorspelbare manier af te geven.
Gerichte toedieningssystemen van dit type hebben verschillende basisvoordelen:omdat het medicijn bij de tumor wordt afgegeven in plaats van wijd door het lichaam te circuleren, het zou effectiever moeten zijn voor een bepaalde dosering. Het zou ook minder schadelijke bijwerkingen moeten hebben omdat kleinere hoeveelheden van het medicijn in contact komen met gezond weefsel.
"We noemen het materiaal nanospons, maar het is eigenlijk meer een driedimensionaal netwerk of steiger, ", zegt Harth. De ruggengraat is een lange lengte polyester. Het wordt in oplossing gemengd met kleine moleculen, cross-linkers genaamd, die werken als kleine grijphaken om verschillende delen van het polymeer aan elkaar te bevestigen. Het netto-effect is om bolvormige deeltjes te vormen gevuld met holtes waar medicijnmoleculen kunnen worden bewaard.De polyester is biologisch afbreekbaar, dus het breekt geleidelijk af in het lichaam. Zoals het doet, het geeft het medicijn dat het bij zich heeft vrij op een voorspelbare manier.
"Voorspelbare afgifte is een van de grote voordelen van dit systeem in vergelijking met andere nanodeeltjesafgiftesystemen die in ontwikkeling zijn, " zegt Harth. Als ze hun doel hebben bereikt, veel andere systemen lossen het grootste deel van hun medicijn op een snelle en oncontroleerbare manier op. Dit wordt het burst-effect genoemd en maakt het moeilijk om effectieve doseringsniveaus te bepalen.
Een ander groot voordeel is dat de nanosponsdeeltjes oplosbaar zijn in water. Door het middel tegen kanker in de nanospons in te kapselen, kunnen hydrofobe geneesmiddelen worden gebruikt die niet gemakkelijk in water oplossen. Momenteel, deze medicijnen moeten worden gemengd met een andere chemische stof, een adjuvans reagens genoemd, dat de werkzaamheid van het medicijn vermindert en nadelige bijwerkingen kan hebben.
Het is ook mogelijk om de grootte van nanosponsdeeltjes te regelen. Door de verhouding van crosslinker tot polymeer te variëren, de nanosponsdeeltjes kunnen groter of kleiner worden gemaakt. Dit is belangrijk omdat uit onderzoek is gebleken dat medicijnafgiftesystemen het beste werken als ze kleiner zijn dan 100 nanometer, over de diepte van de putjes op het oppervlak van een compact disc. De nanosponsdeeltjes die in het huidige onderzoek werden gebruikt, waren 50 nanometer groot. "De relatie tussen deeltjesgrootte en de effectiviteit van deze medicijnafgiftesystemen is het onderwerp van actief onderzoek, ' zegt Harth.
Het andere grote voordeel van het systeem van Harth is de eenvoudige chemie die nodig is. De onderzoekers hebben eenvoudige, high-yield "click chemistry"-methoden voor het maken van de nanosponsdeeltjes en voor het bevestigen van de linkers, die zijn gemaakt van peptiden, relatief kleine biologische moleculen gebouwd door aminozuren aan elkaar te koppelen. "Veel andere medicijnafgiftesystemen vereisen gecompliceerde chemie die moeilijk op te schalen is voor commerciële productie, maar we hebben dit voortdurend in gedachten gehouden, ' zegt Harth.
Het targetingpeptide dat in de dierstudies werd gebruikt, is ontwikkeld door het Hallahan-laboratorium, die ook de effectiviteit van het systeem testte bij tumordragende muizen. Het peptide dat in de studie werd gebruikt, is een peptide dat zich selectief bindt aan tumoren die met bestraling zijn behandeld.
Het medicijn dat voor de dierstudies werd gebruikt, was paclitaxel (de generieke naam van het medicijn Taxol) dat wordt gebruikt bij chemotherapie bij kanker. De onderzoekers registreerden de reactie van twee verschillende tumortypes - langzaam groeiende menselijke borstkanker en snelwerkend muisglioom - op enkele injecties. In beide gevallen ontdekten ze dat het de dood van kankercellen verhoogde en de tumorgroei vertraagde "op een manier die superieur is aan de benaderingen van chemotherapie."
De volgende stap is het uitvoeren van een experiment met herhaalde injecties om te zien of het nanosponssysteem de tumorgroei kan stoppen en omkeren. Harth is ook van plan om de meer uitgebreide toxiciteitsstudies op haar nanodeeltjesafgiftesysteem uit te voeren die nodig zijn voordat het in klinische onderzoeken kan worden gebruikt.
 Wetenschappers ontwikkelen nieuwe transparante breedband afschermende materialen voor elektromagnetische interferentie
Wetenschappers ontwikkelen nieuwe transparante breedband afschermende materialen voor elektromagnetische interferentie Verschil tussen vloeistof en vloeistof
Verschil tussen vloeistof en vloeistof Monash-ingenieurs verbeteren de vermoeiingslevensduur van aluminiumlegeringen met hoge sterkte met 25 keer
Monash-ingenieurs verbeteren de vermoeiingslevensduur van aluminiumlegeringen met hoge sterkte met 25 keer De uitkomst van de wapenwedloop tussen mens en bacterie voorspellen
De uitkomst van de wapenwedloop tussen mens en bacterie voorspellen Als het leven tegen zit, bioplastic maken
Als het leven tegen zit, bioplastic maken
 Nieuwe studie van onderzoekt de complexe wereld van oogstverzekeringen
Nieuwe studie van onderzoekt de complexe wereld van oogstverzekeringen Cedar Tree Identification
Cedar Tree Identification Hoe beïnvloeden landvormen en wateren het klimaat?
Hoe beïnvloeden landvormen en wateren het klimaat?  Steden hebben meer nodig dan airconditioning om hittegolven te doorstaan
Steden hebben meer nodig dan airconditioning om hittegolven te doorstaan 9 staten klagen EPA aan voor algemene vrijstelling terwijl natie pandemie bestrijdt
9 staten klagen EPA aan voor algemene vrijstelling terwijl natie pandemie bestrijdt
Hoofdlijnen
- Vissen hebben complexe persoonlijkheden, uit onderzoek blijkt
- Inleiding tot hoe gigantische virussen werken
- Wat zijn de voor- en nadelen van flowcytometrie?
- Nieuwe studie benadrukt de effecten van een wereldwijde strategie om de antibioticaconsumptie in de productie van voedseldieren te verminderen
- Uit welke elementen bestaat glucose?
- Is vissen met elektriciteit minder destructief dan de zeebodem opgraven met boomkorren?
- Wat is het belang van nucleïnezuren?
- Cephalization of Earthworms
- Waar worden vezels gefermenteerd in het spijsverteringskanaal van het varken?
- Onderzoekers leiden de zelfassemblage van gouden nanodeeltjes in apparaatklare dunne films

- De grenzen van elastische geleiders oprekken

- Gerichte microbellen gebruiken om giftige kankermedicijnen toe te dienen
- Onderzoekers ontdekken nieuwe methode om nanobellen in water te genereren

- JILA-monsterverwerking van 5 minuten verbetert de beeldvorming en analyse van DNA
 Astronomen beschrijven een gewelddadige uitbarsting van een zwart gat die nieuw inzicht verschaft in de evolutie van melkwegclusters
Astronomen beschrijven een gewelddadige uitbarsting van een zwart gat die nieuw inzicht verschaft in de evolutie van melkwegclusters Overstromingen door moesson in India meer dan 200 doden
Overstromingen door moesson in India meer dan 200 doden Leraren moeten harder werken dan andere professionals, zegt studie
Leraren moeten harder werken dan andere professionals, zegt studie Single-spin elektron paramagnetisch resonantiespectrum met kilohertz spectrale resolutie
Single-spin elektron paramagnetisch resonantiespectrum met kilohertz spectrale resolutie Metingen met hogere precisie tonen protonmassa minder dan gedacht
Metingen met hogere precisie tonen protonmassa minder dan gedacht Afbeelding:Hubble ziet pasgeboren sterren in de armen van een spiraalstelsel
Afbeelding:Hubble ziet pasgeboren sterren in de armen van een spiraalstelsel Common Sense Conduit Bending & Cable Tray Techniques
Common Sense Conduit Bending & Cable Tray Techniques Microbiële kolonisten van Arctische bodems zijn gevoelig voor toekomstige klimaatverandering
Microbiële kolonisten van Arctische bodems zijn gevoelig voor toekomstige klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

