
Wetenschap
Hoe Kf
Als je ooit ijs hebt gemaakt met een ouderwetse churn, dan heb je vriespunt depressie gezien - aangeduid als Tf - in actie. Vriespuntverlaging is de toevoeging van een opgeloste stof om het vriespunt van een oplossing te verlagen. In het voorbeeld van de ijskarnton wordt zout toegevoegd aan gemalen ijs, dat de oplossing onder nul graden Celcius brengt en de zoete room in de gelegenheid stelt te bevriezen. Voor het berekenen van de vriespuntverlagingconstante, of Kf, hebt u de vergelijking nodig: delta Tf = Kfcm waarbij cm de molale concentratie van de oplossing is.
Schrijf op wat u weet. Omdat Kf een constante is, of een getal dat altijd hetzelfde is, wordt het vaak weergegeven in een diagram of tabel in scheikundeboeken. Als u geen Kf-waarde ziet in het probleem, blader dan naar de achterkant van het boek en zoek naar een Kf-tabel in de bijlagen. U hoeft misschien geen waarde voor uzelf te berekenen.
Herschrijf de vergelijking. Als Kf niet wordt geleverd, moet je het oplossen met een herziene vriespunt-depressievergelijking. Verdeel de vriespuntverlaging door de molale concentratie, zodat u hebt: Kf = delta Tf /cm.
Voer de waarden in voor delta Tf en cm. Als u bijvoorbeeld een oplossing heeft met een molaliteit van 0,455 die bevriest bij 3,17 graden Celsius, dan zou Kf gelijk zijn aan 3,17 gedeeld door 0,455 of 6,96 graden Celsius.
TL; DR (te lang; niet gelezen )
Scheikundeproblemen vereisen vaak meer dan één vergelijking. U moet bijvoorbeeld de molaliteit berekenen voordat u het in de vriespuntdepressievergelijking kunt plaatsen. Molaliteit is gelijk aan de hoeveelheid opgeloste stof in mol boven de massa van het oplosmiddel in kilogram
Hoofdlijnen
- Zijn psychische aandoeningen genetisch bepaald?
- Waarom kunnen we de voetstappen van anderen horen,
- Een model van een cel-kern maken
- Wat zijn de purine basen van DNA?
- Hoe maak je een DNA-model van kralen en rietjes
- Berekening van celconcentratie
- Het kwantumfysica-concept van kritische massa
- Chromosomale afwijkingen: wat is het?, Typen en oorzaken
- Stadia van meiose met een beschrijving
- Hoe het verschil te weten tussen een verticale asymptoot en een gat, in de grafiek van een rationale functie
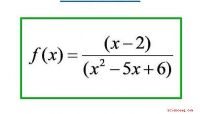
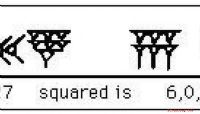
- De geschiedenis van exponenten
- Hoe Fraction Bars

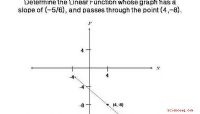
- De vergelijking van een lineaire functie schrijven waarvan de grafiek een rechte heeft met een helling van (-5/6) en door het punt gaat (4, -8)
- Een lijst van de stappen in de informatieverwerkingscyclus

 Wiskundeprojecten voor middelbare scholieren
Wiskundeprojecten voor middelbare scholieren  Waarom helpen rijmpjes mensen dingen te onthouden?
Waarom helpen rijmpjes mensen dingen te onthouden?  Vijf soorten atomaire modellen
Vijf soorten atomaire modellen Wat gebeurt er wanneer een ionische verbinding oplost in water?
Wat gebeurt er wanneer een ionische verbinding oplost in water?  Hoe maak je je eigen kalkbatterij
Hoe maak je je eigen kalkbatterij  Nummers schrijven in uitgebreide vorm
Nummers schrijven in uitgebreide vorm  Populatie-ecologie: definitie, kenmerken, theorie en voorbeelden
Populatie-ecologie: definitie, kenmerken, theorie en voorbeelden Lichtvervuiling steelt de nacht
Lichtvervuiling steelt de nacht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


