
Wetenschap
Waarom heeft FR de grootste atoomstraal?
* Atomic Radius -trend: Atomische straal neemt in het algemeen toe naarmate u een groep (kolom) naar beneden beweegt en neemt af naarmate u over een periode (rij) in de periodiek systeem beweegt.
* Positie van Francium: Francium bevindt zich in de linkeronderhoek van het periodiek systeem. Dit betekent dat het in de eerste groep (Alkali metalen) en de zevende periode zit.
* Redenen voor grote straal:
* Meer elektronenschalen: Terwijl u een groep naar beneden beweegt, krijgen atomen extra elektronenschalen, waardoor de afstand tussen de buitenste elektronen en de kern effectief wordt vergroot. Francium heeft veel elektronenschalen.
* Afschermingseffect: De binnenste elektronen beschermen de buitenste elektronen tegen de volledige positieve lading van de kern. Dit afschermingseffect is sterker in francium vanwege de vele elektronenschalen.
* Zwakke nucleaire aantrekkingskracht: De kern in Francium heeft een groot aantal protonen, maar de buitenste elektronen zijn erg ver weg, waardoor de aantrekkelijke kracht wordt verminderd.
Samenvattend: Francium's positie in de linkeronderhoek van het periodiek systeem, gecombineerd met zijn vele elektronenschalen en het afschermingseffect, resulteert in een zeer grote atoomradius. Het is de grootste van alle bekende elementen.
 Nieuwe vloeibare kristallen geproduceerd door het stapelen van anti-aromatische eenheden zouden kunnen leiden tot vooruitgang op het gebied van organische halfgeleiders
Nieuwe vloeibare kristallen geproduceerd door het stapelen van anti-aromatische eenheden zouden kunnen leiden tot vooruitgang op het gebied van organische halfgeleiders  Wat gebeurt er als magnesium reageert met verdund zwavelzuur?
Wat gebeurt er als magnesium reageert met verdund zwavelzuur?  Waarom verandert droge Hcl de kleur van lakmoespapier niet?
Waarom verandert droge Hcl de kleur van lakmoespapier niet?  Wetenschappers analyseren de chemische bindingen die eiwitten vormen
Wetenschappers analyseren de chemische bindingen die eiwitten vormen Wat is de chemische formule van tafelazijn?
Wat is de chemische formule van tafelazijn?
 Steden en landen streven ernaar om binnen tien jaar plastic afval te verminderen
Steden en landen streven ernaar om binnen tien jaar plastic afval te verminderen Kan herbegroeiing de bodem van de fotovoltaïsche zonne-energie in zijn ongerepte glorie herstellen?
Kan herbegroeiing de bodem van de fotovoltaïsche zonne-energie in zijn ongerepte glorie herstellen? Netwerk van toonaangevende experts op het gebied van bosherstel met nieuwe website
Netwerk van toonaangevende experts op het gebied van bosherstel met nieuwe website Geradicaliseerd en gelovend in complotten:kan de cyclus doorbroken worden?
Geradicaliseerd en gelovend in complotten:kan de cyclus doorbroken worden?  Waarom is de sabeltandtijger uitgestorven?
Waarom is de sabeltandtijger uitgestorven?
Hoofdlijnen
- Precies weten wat genen zeggen – en waar
- Wat zijn voorbeelden van estivatie?
- Wetenschappers werken aan een omkeerbare vorm van genbewerking
- Het niveau van eiwitstructuur dat de sequentie -aminozuren is?
- Wanneer cellen niet reageren op normale controles over groei en verdeling, vormen ze weefselmassa bekend als?
- orang-oetans, zoals mensen, geneeskrachtige planten gebruiken om gewrichts- en spierontsteking te behandelen
- Intra-rij onkruid wieden mogelijk met vision-systemen
- Wat is het sorteren in de wetenschap?
- Wie is de vader van voedselmicrobiologie?
- Een nieuw testbed voor niet-evenwichtige veellichamenfysica

- Spectraal-volumetrisch gecomprimeerde ultrasnelle fotografie legt tegelijkertijd 5D-gegevens vast in een enkele snapshot

- Snel, robuust algoritme voor het berekenen van stellaratorspoelvormen levert ontwerpen op die gemakkelijker te bouwen en te onderhouden zijn
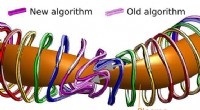
- Wetenschappers hebben een nieuw concept van wiskundige modellering ontwikkeld
- Toplab CERN lanceert belangrijke nieuwe accelerator

 Zeggen dat de aarde niet centraal staat in het universum dat zegt?
Zeggen dat de aarde niet centraal staat in het universum dat zegt?  De onzichtbare kracht van fladderen - van vliegtuigcrashes tot snurken tot gratis energie
De onzichtbare kracht van fladderen - van vliegtuigcrashes tot snurken tot gratis energie Wereldwijd oceaanrapport toont ongekende impact van klimaatverandering, aangezien de Noordpoolregisters lage ijsniveaus registreren
Wereldwijd oceaanrapport toont ongekende impact van klimaatverandering, aangezien de Noordpoolregisters lage ijsniveaus registreren Hubble ziet een sterrenstelsel gehuld in sterren
Hubble ziet een sterrenstelsel gehuld in sterren  3 redenen waarom eiwitten zo belangrijk voor ons zijn?
3 redenen waarom eiwitten zo belangrijk voor ons zijn?  Externe bemesting in chordaten
Externe bemesting in chordaten  Hoe spelen dieren die niet-decomposers zijn een belangrijke rol bij ontleding?
Hoe spelen dieren die niet-decomposers zijn een belangrijke rol bij ontleding?  Welke elementen zijn vast bij kamertemperatuur en ductiel?
Welke elementen zijn vast bij kamertemperatuur en ductiel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

