
Wetenschap
Waarom onderscheidt waterstof zich, waarom staat het op zichzelf?
1. Unieke elektronische structuur:Waterstof heeft een unieke elektronische structuur vergeleken met andere elementen. Het heeft slechts één elektron dat rond zijn kern draait, waardoor het het eenvoudigste atoom is. Dit enkele elektron kan gemakkelijk verloren gaan of gedeeld worden, waardoor waterstof zijn karakteristieke chemische eigenschappen krijgt.
2. Positie in het periodiek systeem:Waterstof staat bovenaan het periodiek systeem, in Groep 1 (alkalimetalen). Het verschilt echter aanzienlijk van andere alkalimetalen. Terwijl alkalimetalen doorgaans hun enkele valentie-elektron verliezen om positieve ionen te vormen, kan waterstof zowel zijn elektron verliezen om een positief geladen ion (H+) te worden als een elektron winnen om een negatief geladen ion (H-) te worden.
3. Tweeledig karakter:Waterstof heeft een tweeledig karakter en gedraagt zich zowel als metaal als als niet-metaal. Het kan ionische verbindingen vormen zoals metalen (bijvoorbeeld natriumhydride, NaH) en covalente verbindingen zoals niet-metalen (bijvoorbeeld waterstofchloride, HCl). Deze veelzijdigheid maakt waterstof uniek en zorgt ervoor dat het een breed scala aan verbindingen kan vormen.
4. Overvloed:Waterstof is het meest voorkomende element in het universum en vormt een aanzienlijk deel van de atmosfeer, het water en de organische moleculen van de aarde. De prevalentie en hoge reactiviteit ervan dragen bij aan de vitale rol ervan in verschillende chemische processen.
5. Isotopen:Waterstof heeft drie natuurlijk voorkomende isotopen:protium (¹H), deuterium (²H, ook bekend als zware waterstof) en tritium (³H). Deze isotopen hebben verschillende aantallen neutronen in hun kernen en vertonen enigszins verschillende fysische en chemische eigenschappen.
Vanwege deze verschillende kenmerken wordt waterstof vaak als een speciaal geval beschouwd en wordt het afzonderlijk van andere elementen in het periodiek systeem geplaatst. De unieke eigenschappen maken het essentieel voor talloze chemische reacties en spelen een centrale rol in veel wetenschapsgebieden, waaronder scheikunde, natuurkunde en biologie.
 Darwin in een reageerbuis:Trio wint Nobelprijs voor het benutten van evolutie
Darwin in een reageerbuis:Trio wint Nobelprijs voor het benutten van evolutie Wat verandert verschillende kleuren in zuren en basen?
Wat verandert verschillende kleuren in zuren en basen?  Voordelen van het gebruik van een pH-meter
Voordelen van het gebruik van een pH-meter  Welke massa waterstofchloride is nodig om te reageren met 100 g roest?
Welke massa waterstofchloride is nodig om te reageren met 100 g roest?  Onderzoeksdoorbraak kan technologie voor schone energie transformeren
Onderzoeksdoorbraak kan technologie voor schone energie transformeren
 Nederlands hof van beroep bevestigt historische uitspraak in klimaatzaak
Nederlands hof van beroep bevestigt historische uitspraak in klimaatzaak Grotten geven aan dat de Australische bergen nog steeds groeien
Grotten geven aan dat de Australische bergen nog steeds groeien 10 jaar sinds de aardbeving in Darfield Nieuw-Zeeland deed schudden:wat hebben we geleerd?
10 jaar sinds de aardbeving in Darfield Nieuw-Zeeland deed schudden:wat hebben we geleerd? Sociale en milieukosten van waterkracht worden onderschat, studie toont
Sociale en milieukosten van waterkracht worden onderschat, studie toont Hoe beschrijf je de niveaus van organisatie die in je biome leven
Hoe beschrijf je de niveaus van organisatie die in je biome leven
Hoofdlijnen
- Als het vet uit voedsel komt, wat gaat er dan in?
- Hoe een biologisch diagram te tekenen
- Het genoom doorlussen - hoe cohesine voor de gek houdt
- Studie:Net als een boom laten jaarringen de leeftijd van de kreeft zien
- We volgen al 18 jaar vogels in een klein Nigeriaans bos - wat we hebben gevonden en waarom het ertoe doet
- Onderzoekers ontdekken hoe fotosynthetische organismen ATP reguleren en synthetiseren
- Hoe spreken felle kleuren kinderen aan?
- Nieuw onderzoek wijst uit waarom sommige microbiële genen meer promiscue zijn dan andere
- Hoe weten cellen wanneer ze de celcyclus moeten doorlopen? Nieuwe studie vindt verband tussen verdeeldheid en groeisnelheid
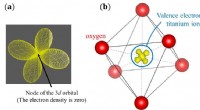
- Directe waarneming van een enkele elektronen vlindervormige verdeling in titaniumoxide
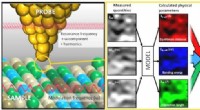
- Onderzoekers zetten atoomkrachtmicroscoopmetingen om in kleurenafbeeldingen
- Onderzoekers verbeteren de levensduur van qubits voor kwantumcomputers

- Nieuwe theorie over de oorsprong van donkere materie
- Indringende microscopisch kleine bewegingen in squishy materialen

 Hoe planten wonden genezen:mechanische krachten bepalen de richting van celdeling
Hoe planten wonden genezen:mechanische krachten bepalen de richting van celdeling  Elektrische geleiding over een enkel molecuul meten
Elektrische geleiding over een enkel molecuul meten Grafeenonderzoekers maken een laagcake met atomaire precisie
Grafeenonderzoekers maken een laagcake met atomaire precisie Welzijn van achtergebleven kinderen in Kirgizië focus van studie
Welzijn van achtergebleven kinderen in Kirgizië focus van studie Bemanningen zorgen voor een knaller om het Deep Underground Neutrino-experiment naar de volgende fase te brengen
Bemanningen zorgen voor een knaller om het Deep Underground Neutrino-experiment naar de volgende fase te brengen De wereld treft 8 miljard mensen; Is dat goed of slecht?
De wereld treft 8 miljard mensen; Is dat goed of slecht?  'Jong, mannelijk en doelloos':waarom stellen mannen in India het huwelijk uit?
'Jong, mannelijk en doelloos':waarom stellen mannen in India het huwelijk uit?  Kan housemuziek de energiecrisis oplossen?
Kan housemuziek de energiecrisis oplossen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

