
Wetenschap
Nanoscopische eiwitbeweging op een levend celmembraan
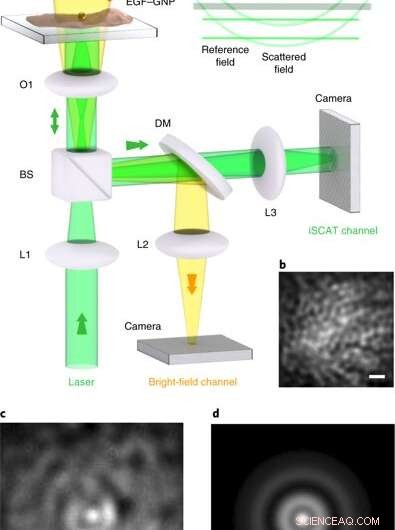
iSCAT-microscopie op levende cellen. een, Experimentele opstelling van de iSCAT-microscoop voor live-celbeeldvorming. Cellen worden uitgeplaat in een schaal met glazen bodem onder Leibowitz-medium. (a) micropipet levert de EGF-BNP-sondes rechtstreeks op de celcultuur, waar ze zich specifiek richten op het EGFR-eiwit in het celmembraan. Het helderveldverlichtingskanaal van bovenaf helpt bij het inspecteren van de cultuur, maar is niet vereist voor iSCAT-beeldvorming. L1-L3, lenzen; O1, × 100 objectief; BS, 90:10 bundelsplitser; DM, 590 nm short-pass dichroïsche spiegel. iSCAT-beeldvorming werd uitgevoerd met verlichtingsintensiteiten van 1-8 kW cm−2, waarvan bekend is dat ze levensvatbaar zijn voor HeLa op de van belang zijnde golflengte. inzet, golffronten van de velden die bijdragen aan het iSCAT-signaal. (B), Een deel van het membraan van de HeLa-cel voor het labelen, bekeken via reflectie iSCAT. (C), iSCAT-beeld van het celmembraan inclusief een gebonden EGF-BNP-sonde. (NS), De PSF gewonnen uit c. Schaalbalken in b-d zijn 1 μm. Credit: Natuurfotonica , doi:10.1038/s41566-019-0414-6
Cellulaire functies worden bepaald door de ingewikkelde beweging van eiwitten in membranen die zich uitstrekken over een schaal van nanometers tot micrometers, binnen een tijdsbestek van microseconden tot minuten. Echter, deze rijke parameter van de ruimte is ontoegankelijk met behulp van fluorescentiemicroscopie, hoewel het binnen het bereik van interferometrische verstrooiing (iSCAT) deeltjesvolging ligt. De nieuwe iSCAT-techniek is, echter, zeer gevoelig voor enkelvoudige en ongelabelde eiwitten, waardoor niet-specifieke achtergrondkleuring wordt veroorzaakt als een aanzienlijke uitdaging tijdens cellulaire beeldvorming.
In een recente studie, Richard W. Taylor en collega's van de interdisciplinaire afdelingen Natuurkunde en Biologie in Duitsland ontwikkelden een nieuwe benadering voor beeldverwerking om dit probleem te verhelpen. Ze gebruikten de methode om de transmembraan epidermale groeifactorreceptor (EGFR) te volgen met precisie op nanometerschaal in drie dimensies (3-D). De techniek maakte beeldvorming van microseconden tot minuten mogelijk. De wetenschappers gaven voorbeelden van beweging en opsluiting op nanoschaal met behulp van de methode om alomtegenwoordige processen in beeld te brengen, zoals diffusie in plasmamembranen, transport in filopodia en roterende beweging tijdens endocytose. De resultaten zijn nu gepubliceerd in Natuurfotonica .
Hoewel gestage vooruitgang in fluorescentiemicroscopie wetenschappers in staat heeft gesteld cellulaire gebeurtenissen op nanometerschaal te volgen, er moet nog veel worden bereikt met geavanceerde beeldvormingssystemen. De uitdagingen van fluorescentiemicroscopie deden zich voor vanwege de eindige emissiesnelheid van een fluorescerende bron (kleurstofmolecuul of halfgeleider kwantumpunt), waar te weinig fotonenemissies gedurende een zeer korte tijdspanne effectieve of langdurige beeldvorming verhinderden. De centrale moeilijkheid van op verstrooiing gebaseerde microscopie is ten opzichte van de nanoscopische sonde, die concurreert met de achtergrondruis en een lage signaal-ruisverhouding (SNR); het beperken van het potentieel van beeldvorming tot slechts enkele nanometers in high-speed tracking-experimenten.

Ruwe video van een epidermale groeifactor-gouden nanodeeltje (EGFR-BNP) dat diffundeert op een HeLa-celmembraan. Credit: Natuurfotonica , doi:10.1038/s41566-019-0414-6
In het huidige werk, Taylor et al. gebruikte interferometrische verstrooiing (iSCAT) microscopie om eiwitten in levende celmembranen te volgen. De methode kan sonde-celinteracties visualiseren om de dynamiek tussen diffusie en lokale topologie te begrijpen. Tijdens de experimenten, de wetenschappers gebruikten gouden nanodeeltjes (BNP's) om epidermale groeifactorreceptoren (EGFR's) in HeLa-cellen te labelen. De EGFR's zijn type I transmembraaneiwitten die extracellulaire signalen kunnen detecteren en erop kunnen reageren, wiens afwijkende signalering verband houdt met een verscheidenheid aan ziekten. Taylor et al. toonde het BNP-gelabelde eiwit als een 'nano-rover' die de nano-topologie van cellulaire kenmerken in kaart bracht, zoals membraanterreinen, filopodia en clathrin structuren. Ze gaven voorbeelden van subdiffusie en nanoscopische opsluitingsbeweging van een eiwit in 3D met een hoge temporele resolutie en lange tijdspunten.
In de experimenten, Taylor et al. introduceerde de epidermale groeifactor-gouden nanodeeltjes (EGF-BNP) sondes in de monsterkamer van de microscoop met behulp van een micropipet om de EGFR's (epidermale groeifactorreceptoren) op HeLa-cellen te labelen en geverifieerd dat de sondes de EGFR's stimuleerden. Eerdere studies hadden al aangetoond dat de grootte van de sonde de snelheid van lipidediffusie in synthetische membranen zou kunnen beïnvloeden, hoewel ze de verspreidingswijze niet beïnvloedden. Aanvullend, in levende cellen, moleculaire crowding was verwaarloosbaar voor deeltjes gelijk aan of kleiner dan 50 nm.
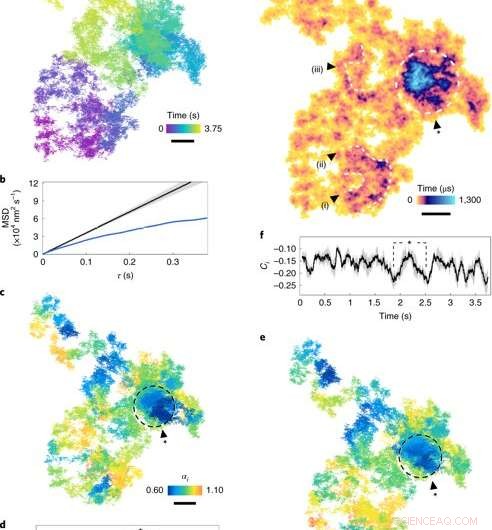
Diffusie op het plasmamembraan. (een), Een lateraal diffusietraject (17,5 μs belichtingstijd, zie kleurenschaal voor chronologie). (B), MSD (gemiddelde vierkante verplaatsing) versus τ. De blauwe curve toont de MSD van a. De zwarte curve is gesimuleerde normale diffusie (α= 1), met de grijze envelop die de onzekerheid aangeeft. (C), De diffusie-exponent van rollende vensters (kleurenschaal) over het traject. Subdiffusiegebieden (α<1) worden aangegeven met donkere tinten. (NS), ik door de tijd. De grijze arcering vertegenwoordigt een gemiddelde onzekerheid van 7 ± 4%, overeenkomend met een 95%-betrouwbaarheidsinterval voor een venster van 100 ms (1, 000 frames) en τ= 250 μs. De punten gemarkeerd met het sterretje komen overeen met de cirkel in c. (e), De staprichting Ci voor rollende ramen langs het traject. (F), De stap-richting Ci uitgezet door de tijd, met de arcering die onzekerheid aanduidt. (G), ATOM-bezettingsperceel met verblijftijd (kleurenschaal). De bakgrootte komt overeen met de lokalisatiefout. Opmerkelijke regio's van uitgebreide bezetting, gemarkeerd als lussen en wervelingen (i)–(iii), zijn indicatief voor persistente nanoscopische structuren. Het ingesloten gebied vertegenwoordigt een dichte patch van opmerkelijke subdiffusie. Schaalbalken, 100 nm. Credit: Natuurfotonica , doi:10.1038/s41566-019-0414-6
Taylor et al. verifieerde deze twee concrete gevallen in het huidige werk door BNP's van verschillende diameters bij 48 nm en 20 nm te vergelijken. De wetenschappers voerden vervolgens fluorescerende en biochemische onderzoeken uit om te suggereren dat de EGF-gecoate BNP's EGFR-signalering activeerden, net als de vrij beschikbare EFG's, wat aangeeft dat het label biologische functies niet hinderde. Om achtergrondruis gerelateerd aan moleculaire beeldvorming te overwinnen, implementeerden de wetenschappers een nieuw algoritme, die voor de duidelijkheid de volledige iSCAT-puntspreidingsfunctie (iSCAT-PSF) rechtstreeks uit elk frame heeft geëxtraheerd. Aangezien bestaande technieken geen kenmerken kunnen visualiseren met een hoge ruimtelijke en temporele resolutie, veel details over intracellulaire activiteit blijven een punt van discussie. In antwoord, de nieuwe methode van Taylor et al. bood een schat aan dynamische heterogeniteiten in 3D om licht te werpen op intracellulaire eiwitbeweging.
De wetenschappers bestudeerden eerst kwantitatief subdiffusie in het plasmamembraan door een 2D-voorbeeld van de EGFR-reis op het membraan van een levende HeLa-cel te beschouwen. Voor deze, ze berekenden de gemiddelde vierkante verplaatsing (MSD) voor het hele bewegingstraject. Taylor et al. hoefde tijdens de berekening geen aannames te doen over de aard van diffusie of het geografische landschap. Ze maten het optreden van biologische diffractieve barrières en opsluitingen door de mate van directionele correlatie tussen twee vectoriële stappen over een tijdspanne te observeren.

Diffusie op een filopodium. Credit: Natuurfotonica , doi:10.1038/s41566-019-0414-6
De wetenschappers beoordeelden vervolgens de populariteit van elke trajectpixel in de ruimte door een geaccumuleerde tijdelijke bezettingskaart (ATOM) te introduceren. Bij deze techniek, ze verdeelden het laterale vlak van het traject in bakken ter grootte van nanometers en telden het voorkomen van het deeltje in elke bak. De resultaten wezen op de rangschikking van nanostructuren in lussen en wervelingen binnen een minimale levensduur van 250 nanoseconden (5000 frames) om mogelijk een pre-endocytische stap weer te geven. In totaal, de gesimuleerde waarnemingen lieten zien hoe eiwitdiffusie werd beïnvloed door de substructuur van de cel.
Met de iSCAT-microscopietechniek konden wetenschappers effecten gedurende een zeer lange periode vastleggen, die ze samen met 3D-beeldvormingsmogelijkheden gebruikten om EGFR's op een filopodium te volgen. De filopodia zijn biologisch staafachtige cellulaire uitsteeksels die bundels actinefilamenten bevatten met een diameter tot 100 tot 300 nm en een lengte van 100 µm. De nanostructuren kunnen mechanische stimuli detecteren voor chemoattractie of afstoting in de cellulaire micro-omgeving terwijl ze plaatsen bieden voor celhechting. Ligandbinding en EFGR-activering op filopodia kwamen voor bij lage concentraties EGF, gevolgd door de associatie met actinefilamenten en retrograde transport van EFGR naar het cellichaam.
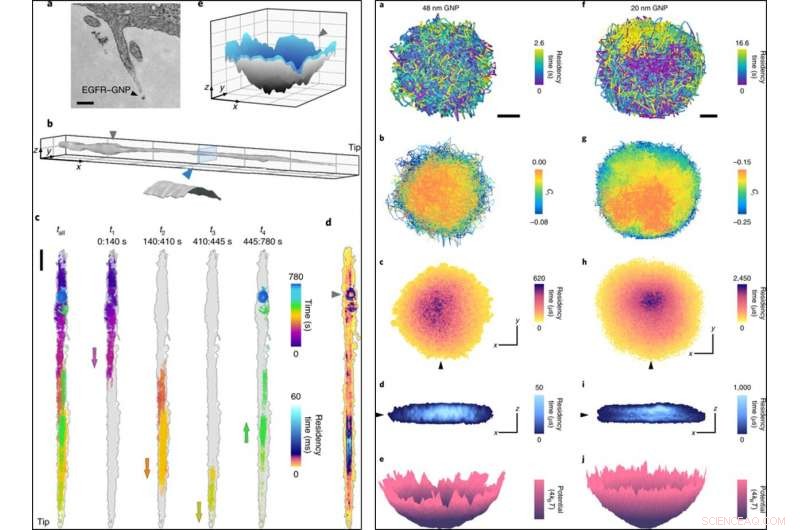
LINKS:(a) Een TEM-beeld (transmissie-elektronenmicroscoop) van een filopodium inclusief een EGFR-BNP. (B), Een filopodium-oppervlak gereconstrueerd uit 780, 000 trajectpunten met een lokalisatiefout van σx, y = 2 nm geregistreerd bij 1, 000 fps. inzet, dwarsdoorsnede die een cilindrisch oppervlak met een diameter van 150 nm weergeeft, rekening houdend met de grootte van het BNP. (C), Een onbewerkte 13 min traject (links) opgedeeld in vier opeenvolgende stukken die de reis van en naar de punt onthullen, met pijlen die de richting van de netbeweging aangeven. (NS), Een ATOM-plot van c, gecorrigeerd voor filopodium drift. (e), Een oppervlakte-interpolatie uit de laatste jaren 80. De ringvormige opsluiting in de laatste fase (gemarkeerd met een driehoek) is een 3D-put. De schaalstaven zijn 200 nm (a), 1 μm (x, y) en 200 nm (z) (b), 1, 000 nm (c) en 100 nm (x, y) en 50 nm (z) (e). RECHTS:(a), Een lateraal traject van een 48 nm BNP-sonde. Schaalbalk, 100 nm. Een lagere temporele bemonstering van deze opsluiting zou de mate van begrenzing hebben onderschat. (B), Ci van het traject (met een vertraging van vijf frames), die gedeeltelijk gehinderde diffusie vertoont met een neiging tot vrijere diffusie in het centrum. (C), Een ATOM-plot van a. (NS), Een snede door de 3D-ATOM-grafiek langs de lijn van de zwarte driehoek in c laat zien dat bezetting de voorkeur geeft aan een binnenste schijfachtig gebied. De assen geven 100 nm aan in zowel c als d. (e), Omzetting van de tijdelijke 2D bezetting van c naar een effectieve potentiële energieverdeling. (v–j), Gelijk aan a-e, maar voor een 20 nm BNP-sonde. Credit: Natuurfotonica , doi:10.1038/s41566-019-0414-6
De wetenschappers kregen zo inzicht in de nanoscopische details van diffusie langs het filopodium en registreerden de gegevens gedurende 13 minuten. Ze analyseerden het 3D-traject om de filopodium-topografie te creëren met behulp van gouden nanodeeltjes als een 'nano-rover' en brachten de oppervlaktetopologie van cellulaire structuren in kaart voor dieper onderzoek. Ze plotten het traject ATOM (geaccumuleerde temporele bezettingskaart) en ontdekten dat de 3D-weergave consistent was met de biologische stap van pre-endocytische membraaninvaginatie.
High-speed microscopietechnieken zoals iSCAT zijn nodig om temporele informatie met hoge resolutie te verkrijgen en vervagingseffecten te voorkomen tijdens op nanodeeltjes gebaseerde beeldvorming. De wetenschappers demonstreerden deze functie door beperkte diffusie vast te leggen op 30, 000 fps (frames per seconde) met 48 nm en 20 nm BNP. Ze volgden de experimenten met ultrasnelle 3D-tracking van eiwitten op 66, 000 fps met een korte belichtingstijd van 10 µs binnen een tijdsduur van 3,5 seconden. Snelle iSCAT-microscopiebeeldvorming leverde verder bewijs om de ingewikkelde kenmerken van endocytische gebeurtenissen te onthullen ten opzichte van door clathrine gemedieerde endocytose in HeLa-cellen wanneer gesimuleerd door lage concentraties EGF.
Op deze manier, Taylor et al. merkte op dat de nieuwe techniek nanotopografische informatie getrouw kan vastleggen. De resultaten kwamen overeen met de waarnemingen die zijn opgenomen met transmissie-elektronenmicroscopie (TEM) zonder significante verschillen in de reductie van de sondegrootte van 48 nm naar 20 nm, terwijl het nieuwe inzichten geeft. De nieuwe inzichten omvatten details van subdiffusie, nanoscopische opsluiting, 3D-contouren van filopodia- en clathrin-structuren op nanoschaal. De wetenschappers zijn van plan iSCAT te combineren met in situ superresolutie fluorescentiemicroscopie om de trajecten van eiwitten te begrijpen, virussen en andere nanoscopische biologische entiteiten. Taylor et al. streven ernaar om de methoden voor beeldanalyse te verbeteren om in de toekomst BNP's kleiner dan 20 nm te volgen en geloven dat de nieuwe technologie en aanvullende optimalisatie hen in staat zullen stellen om specifiek de levenscyclus van virussen te begrijpen zonder een extern label te gebruiken voor het volgen.
© 2019 Wetenschap X Netwerk
 Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren
Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren Vaccinontwerp kan immuuntherapieën voor kanker drastisch verbeteren
Vaccinontwerp kan immuuntherapieën voor kanker drastisch verbeteren Kunstmatige intelligentie heeft geleerd om olieviscositeit in te schatten
Kunstmatige intelligentie heeft geleerd om olieviscositeit in te schatten Schimmel Rode Zee levert aanknopingspunten voor nieuwe medicijnen tegen epilepsie
Schimmel Rode Zee levert aanknopingspunten voor nieuwe medicijnen tegen epilepsie Zelfassemblage van zeer poreuze kristallijne deeltjes tot nieuwe fotonische materialen voor detectietoepassingen
Zelfassemblage van zeer poreuze kristallijne deeltjes tot nieuwe fotonische materialen voor detectietoepassingen
Hoofdlijnen
- De structuur en functie van mRNA
- Kwallen veranderen van hinderlijk in nuttig product
- Wat is er met androgyn gebeurd?
- De giftige suikerboom:de evolutionaire geschiedenis van een kankerachtig suikergen in kaart brengen
- Hoe een moleculaire schaar op de juiste plaats knipt
- Verrassend snelle evolutie waargenomen bij hagedissoorten
- Community (ecologie): definitie, structuur, theorie en voorbeelden
- Roadkill-pieken van fazanten in de herfst en late winter
- Een RNA TREAT voor Halloween
- Flipping the view:nieuwe microscoop biedt mogelijkheden voor medicijnontdekking, veiligheid

- Verband tussen calorieën en cellulaire ademhaling

- Einstein-de Haas-effect biedt nieuw inzicht in een raadselachtig magnetisch fenomeen

- De veelkleurige fotonen die de kwantuminformatiewetenschap zouden kunnen veranderen

- Onderzoekers ontdekten dat rotatie de zigzag van stijgende deeltjes veroorzaakt
 Het mysterie van kwantumcomputers
Het mysterie van kwantumcomputers NASA heeft geïnvesteerd in het kraken van de koolstofpuzzel van de aarde
NASA heeft geïnvesteerd in het kraken van de koolstofpuzzel van de aarde Wetenschappers ontdekken nieuwe atomair gelaagde, dunne magneet
Wetenschappers ontdekken nieuwe atomair gelaagde, dunne magneet Wat is de functie van een spanningsregelaar?
Wat is de functie van een spanningsregelaar?  Onderzoekers documenteren de oudst bekende bomen in het oosten van Noord-Amerika
Onderzoekers documenteren de oudst bekende bomen in het oosten van Noord-Amerika De oorsprong van fijnstofvervuiling in Guangzhou, China
De oorsprong van fijnstofvervuiling in Guangzhou, China Ongebruikelijk vloeistofgedrag waargenomen bij microzwaartekracht
Ongebruikelijk vloeistofgedrag waargenomen bij microzwaartekracht Arctica beleefde een van de warmste jaren in 2020:studie
Arctica beleefde een van de warmste jaren in 2020:studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

