
Wetenschap
Het mechanisme van het wisselen van cellulaire migratiemodus
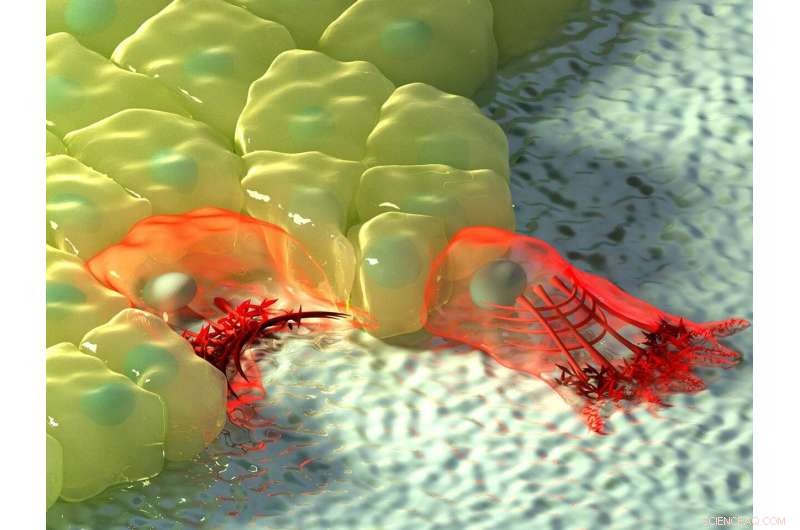
De bovenstaande afbeelding toont een artistieke illustratie van cellen in gebieden met negatieve (links) en positieve kromming (rechts). Bij negatieve kromming, de actinestroom beweegt naar de actinekabel aan de rand van de cel, weergegeven door de toename van de kleurintensiteit, en de samentrekkende kabel tilt de rand boven het substraat. Bij positieve kromming, lamellipodia strekken zich uit van de cel om langs het substraat te kruipen, en deze uitsteeksels worden gekenmerkt door retrograde actinestroom naar de binnenkant van de cel. Krediet:Mechanobiologisch Instituut, Nationale Universiteit van Singapore
Wanneer geconfronteerd met moeilijk terrein, terreinwagens kunnen overschakelen van twee- naar vierwielaandrijving om vooruit te blijven rijden. evenzo, celmigratie kan worden aangedreven door uitsteekselgericht kruipen, of door samentrekkende trekkrachten, maar hoe de cel tussen deze twee methoden schakelt, blijft een mysterie. Een gezamenlijke studie geleid door MBI-promovendus Tianchi Chen en professor Benoit Ladoux van het Mechanobiology Institute (MBI) aan de National University of Singapore, heeft ontdekt dat de richting waarin actinefilamenten in de cel stromen, de cel in staat stelt de fysieke kromming van zijn omgeving waar te nemen, en deze gerichte stroom is de sleutelschakelaar die bepaalt welke methode van migratie wordt geselecteerd. Het werk is gepubliceerd in het aprilnummer van 2019 van: Natuurfysica .
Door kromming geïnduceerde reorganisatie van actinestroom
Celmigratie is een essentieel biologisch proces dat weefsel- en orgaanvorming stimuleert tijdens de embryonale ontwikkeling, en helpt ook het lichaam te beschermen door middel van immuunrespons en wondgenezingsmechanismen. De vormveranderingen die nodig zijn voor celmigratie, zijn afhankelijk van de dynamische organisatie en krachtopwekking van het interne actomyosine-cytoskelet van de cel, die bestaat uit structurele actinefilamenten en contractiele myosine-motoreiwitten.
Reorganisatie van deze componenten maakt twee mechanismen van celmigratie mogelijk:de groei en uitbreiding van op actine gebaseerde lamellipoïdale uitsteeksels waardoor de cel naar buiten kan 'kruipen', of de vorming van grote contractiele actomyosinekabels die de cel naar voren kunnen trekken terwijl ze tractiekrachten op het substraat genereren. Echter, het proces waarbij de cel ervoor kiest om uitsteeksels of contractiele kabels te vormen, blijft onduidelijk.
Afhankelijk van de topografie van de fysieke omgeving, cellen kunnen gebieden met positieve of negatieve kromming tegenkomen. Positieve kromming verwijst naar een convexe vorm die naar buiten buigt, net als een hoofdletter 'D', terwijl een voorbeeld van de tegenovergestelde negatieve kromming te zien is in de letter 'C', die een concave vorm vormt die naar binnen buigt. Door epitheliale celmigratie te observeren op bloemvormige substraatpatronen die worden gebruikt voor wondsluitingsassays, een internationaal, multidisciplinair onderzoeksteam onder leiding van Prof Ladoux in samenwerking met MBI Principal Investigators Associate Professor Boon Chuan Low en Associate Professor Yusuke Toyama, samen met theoretische natuurkundigen en onderzoeksgenoten in Frankrijk, Chili, Israël en Spanje ontdekten dat in gebieden met positieve kromming, cellen ontwikkelden lamellipodia voor het kruipen van cellen, en in gebieden met negatieve kromming, sterke actinekabels geassembleerd die de concave rand volgden.
Verdere observatie van actinedynamiek in realtime met behulp van levende celmicroscopie onthulde een verschil in de richting van actinestroom bij de twee krommingen. In positieve kromming geïnduceerde lamellipodia, de stroom van actine was retrograde, d.w.z. weg van het celmembraan in de tegenovergestelde richting van het uitsteeksel. Omgekeerd, bij negatieve krommingen was de actinestroom anterograde, d.w.z. naar het celmembraan waar de actinekabel zich bevond.
Deze anterograde stroom drijft de assemblage van verschillende, gepolariseerde actinestructuren in deze gebieden met negatieve kromming. De actinekabel aan de holle rand bevindt zich aan de voorzijde, gevolgd door transversale actinevezels die in dezelfde richting zijn georiënteerd als de actinekabel, en aan de achterkant van het netwerk bevinden zich radiale actinevezels die 90 graden ten opzichte van de actinekabel zijn georiënteerd. interessant, de vorming van deze gepolariseerde actinestructuren als reactie op negatieve kromming werd waargenomen in afzonderlijke cellen en celplaten die migreerden op een 2D-oppervlak, en in cellen die zijn ingebed in 3D-vezelnetwerken. Hoewel deze resultaten het bestaan van twee mechanismen van celmigratie bevestigden, er was nog een open vraag over hoe cellen de kromming van de omgeving konden voelen.
Gelukkig, de live-celbeeldvorming bood de onderzoekers een mogelijke aanwijzing - de omschakeling in de richting van de actinestroom, afhankelijk van de kromming, zou mogelijk de 'sensor' kunnen zijn voor het omschakelen van de migratiemodus. Dit werd bevestigd door het uitplaten van epitheelcellen op een oppervlak met micropatroon bedekt met een hechtend substraat, die was bezaaid met niet-klevende cirkelvormige patches. Toen het celblad een niet-klevende cirkel tegenkwam, lamellipodiale uitsteeksels kruipen rond de cirkel, het naar voren trekken van de cellen op het klevende substraat. Dit creëerde automatisch een concave vorm over de niet-klevende cirkel, die een snelle omschakeling in de richting van de actomyosinestroom van retrograde naar anterograde veroorzaakte, resulterend in assemblage van een actinekabel en een switch in migratiemechanisme. De samentrekkende kabel kan de rand van de cel over de niet-klevende cirkel optillen, waardoor de migratie van het celblad kan doorgaan.
Hoewel cellen wel krommingssensoren in hun membraan bevatten, zoals BAR-eiwitten, deze laten alleen de detectie van kromming op moleculair niveau toe. Eigenlijk, door de grootte van deze sensoreiwitten kunnen ze krommingen alleen in hun directe omgeving op nanometerschaal waarnemen, niet op het niveau van de hele cel. Echter, deze studie laat zien hoe cellen grotere krommingsveranderingen van celgrootte kunnen waarnemen op een schaal tot tientallen micrometers, door dynamische aanpassing van de actinestroom.
Dit vermogen stelt de cel in staat een geschikt mechanisme te selecteren om de migratie voort te zetten, ook bij uiteenlopende veranderingen in de fysieke omgeving, net zoals een terreinwagen kan schakelen tussen twee- en vierwielaandrijving, afhankelijk van het terrein. Met de nieuwe kennis van deze actinestroomschakelaar, wetenschappers kunnen misschien beter begrijpen hoe cellen kunnen blijven migreren tijdens wondgenezing, of in situaties waar migratie schadelijk kan zijn, zoals de uitgezaaide progressie van kanker.
 Nieuwe technologie helpt zout te verminderen, smaak behouden
Nieuwe technologie helpt zout te verminderen, smaak behouden Nieuwe plastic biomaterialen kunnen leiden tot hardere, meer veelzijdige medische implantaten
Nieuwe plastic biomaterialen kunnen leiden tot hardere, meer veelzijdige medische implantaten Eetbare coating voor het bewaren van zeebaars
Eetbare coating voor het bewaren van zeebaars Doorbraaktool voorspelt eigenschappen van theoretische materialen
Doorbraaktool voorspelt eigenschappen van theoretische materialen Atomair dunne materialen sinteren met keramiek nu mogelijk
Atomair dunne materialen sinteren met keramiek nu mogelijk
 Californias August Complex grootste brand in de geschiedenis van de staat
Californias August Complex grootste brand in de geschiedenis van de staat Gevolgen van gaten in ontwortelde of gebroken bomen in Amazonië
Gevolgen van gaten in ontwortelde of gebroken bomen in Amazonië Hoe chemische vervuiling te voorkomen
Hoe chemische vervuiling te voorkomen Vermindering van fosfor in meren in China dankzij overheidsinspanningen
Vermindering van fosfor in meren in China dankzij overheidsinspanningen 75-80 procent kans op El Nino in de komende 3 maanden:UN
75-80 procent kans op El Nino in de komende 3 maanden:UN
Hoofdlijnen
- Effecten van mobiele telefoons op studenten
- Verrassende ontdekking - hoe de Afrikaanse tseetseevlieg echt je bloed drinkt
- IJsberen verdringen op Russisch eiland in teken van Arctische verandering
- Laatste gemeenschappelijke aap-menselijke voorouder was waarschijnlijk zo groot als een gibbon
- Onderzoekers ontdekken dat twee verschillende ecologische mechanismen veerkracht kunnen bieden tegen invasieve soorten
- Factoren die celdeling beïnvloeden
- S-fase: wat gebeurt er tijdens deze subfase van de celcyclus?
- Wat is een gen,
- De voordelen van anaërobe ademhaling
- Geef uw microscoop een boost:onderzoekers delen gids voor ultraprecieze 3D-beeldvorming

- Onderzoekers verbeteren algoritmen voor het leren van kwantummachines
- Ultraprecieze sensor op chipschaal detecteert ongekend kleine veranderingen in omgevingsomstandigheden op nanoschaal

- Siliciumchips combineren licht en ultrageluid voor een betere signaalverwerking

- Op aanvraag, fotonische verstrengeling synthesizer
 OSIRIS-REx-camera's en spectrometers getest tijdens flyby van de aarde
OSIRIS-REx-camera's en spectrometers getest tijdens flyby van de aarde Team ontdekt uniek materiaal voor het kwantumtijdperk
Team ontdekt uniek materiaal voor het kwantumtijdperk Communiceren met drones met behulp van gezichtsuitdrukkingen en gebaren kan levens helpen redden
Communiceren met drones met behulp van gezichtsuitdrukkingen en gebaren kan levens helpen redden Hoe ijsdeeltjes de vorming van radicalen bevorderen
Hoe ijsdeeltjes de vorming van radicalen bevorderen Elektrische masten hergebruiken om het dak van een treinstation te ontwerpen
Elektrische masten hergebruiken om het dak van een treinstation te ontwerpen Dat zwarte spul op de weg? Technisch geen asfalt
Dat zwarte spul op de weg? Technisch geen asfalt  Is uw drinkwater veilig? Zo kom je erachter
Is uw drinkwater veilig? Zo kom je erachter Computermodel toont oude aarde met een atmosfeer van 70 procent koolstofdioxide
Computermodel toont oude aarde met een atmosfeer van 70 procent koolstofdioxide
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

