
Wetenschap
Nucleus-specifieke röntgenkleuring voor 3D virtuele histologie
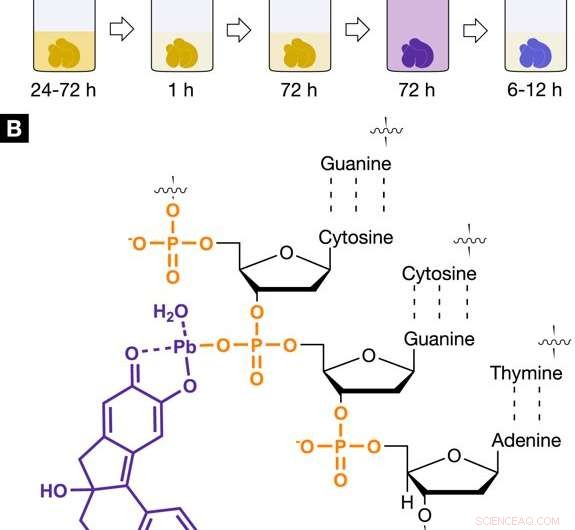
De röntgenfoto geschikt, kernspecifiek kleurmiddelprotocol voor 3D virtuele histologie. Kleuringsprotocol en interactie van de op hemateïne gebaseerde röntgenvlek met zacht weefsel. (A) De ontwikkelde op hemateïne gebaseerde kleuringsprocedure toont de afzonderlijke stappen die betrokken zijn, inclusief incubatie- en kleuringstijden. Kleurstap 1 werd uitgevoerd met gebruikmaking van lood(II)acetaattrihydraat als de bron van zware metalen. Het lood(II)acetaattrihydraat werd opgelost in gedestilleerd water en wordt werkoplossing (A) (WS (A)) genoemd. De kleuringsstap 2 omvatte een hemateïne-oplossing in absolute ethanol (WS (B), 10% (w/v); c = 333 mM), die was afgeleid van hematoxyline en werd toegevoegd aan WS (A). (B) Het positief geladen hemateïne-lood(II)-complex (paars), die in situ is ingebouwd in het monster van zacht weefsel, interageert met de negatief geladen fosfaatruggengraat van het DNA (oranje) dat in de celkern aanwezig is. De selectieve interactie van het hemateïne-lood(II)-complex met het DNA wordt bereikt door verzuring van het zachte weefsel tijdens fixatie of vóór kleuring en zorgt voor een hogere accumulatie van het hemateïne-lood(II)-complex in de celkern. Credit: Wetenschappelijke rapporten , doi:https://doi.org/10.1038/s41598-018-36067-y
Histologie wordt gebruikt om structurele details van weefsel op microschaal in het pathologielab te identificeren, maar analyses blijven tweedimensionaal (2D) omdat ze beperkt zijn tot hetzelfde vlak. Niet-destructieve 3D-technologieën, waaronder röntgenmicro- en nano-computertomografie (nanoCT), hebben hun geldigheid bewezen om anatomische structuren te begrijpen, omdat ze willekeurige kijkhoeken en structurele 3D-details mogelijk maken. Echter, lage verzwakking van zacht weefsel heeft hun toepassing op het gebied van 3D virtuele histologie belemmerd. In een recente studie, nu gepubliceerd op Wetenschappelijke rapporten , Mark Müller en collega's van de afdeling Natuurkunde en Bio-engineering hebben een op hemateïne gebaseerde röntgenkleuringsmethode ontwikkeld om specifiek celkernen te targeten, gevolgd door demonstraties op een hele leverlobule van een muis.
Het nieuwe kleuringsprotocol combineerde de recent ontwikkelde, nanoCT-systeem met hoge resolutie voor 3D-visualisatie van de weefselarchitectuur op nanometerschaal. De resultaten onthulden de echte 3D-morfologie naast de ruimtelijke verdeling van celkernen. De techniek was ook compatibel met conventionele histologie, aangezien microscopisch kleine objectglaasjes met een monster van zacht weefsel met hetzelfde protocol kunnen worden gekleurd naast aanvullende tegenkleuring. De methode demonstreerde de mogelijkheid voor toekomstige toepassingen in histopathologie, vergezeld van röntgen-CT-apparaten in het laboratorium.
Histologie is de bestaande gouden standaard voor een nauwkeurige microanatomische diagnose in het pathologielab, technieken en resultaten zijn echter beperkt tot 2D. Bijvoorbeeld, een 3D-biopsie wordt meestal onderzocht met behulp van zeer dunne microscopische objectglaasjes (met plakjes van 2-10 µm dik) via conventionele en moderne immunohistochemische en histologische kleuringstechnieken. Micro- en nano-CT zijn krachtige hulpmiddelen die een nauwkeurige reconstructie van weefsel in 3D kunnen bieden. Ontwikkelingen op het gebied van technologie hebben een relatief hoge resolutie mogelijk gemaakt voor bestaande 2D conventionele histologie, met behulp van apparaten variërend van grote deeltjesversnellers tot laboratoriumgebaseerde röntgenapparaten.
Naast de technische vereisten, Röntgen geschikte kleurstoffen (contrastmiddelen) zoals fotowolfraamzuur (PTA), jodium kaliumjodide (IKI), jodium in ethanol (12E), of jodium in methanol (12M) zijn ook belangrijk. De beschikbare kleurstoffen zijn echter momenteel beperkt in omvang en werkzaamheid. Bij het ontwikkelen van medische diagnostiek van de volgende generatie in de histopathologie, wetenschappers streven ernaar de technieken te optimaliseren en weefselarchitectuur te begrijpen van het cellulaire niveau tot de weefselschaal.
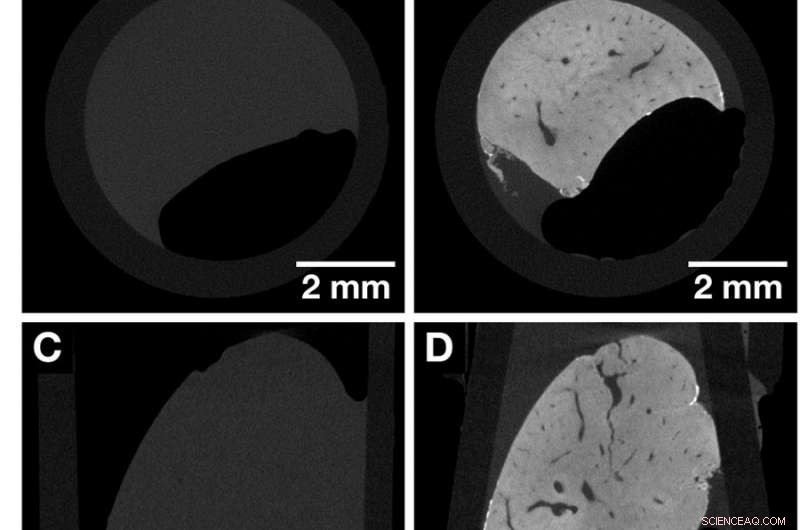
CT-plakjes van dezelfde leverkwab van de muis voor en na de kleuring die de contrastverbetering benadrukken die is verkregen na het aanbrengen van de op hemateïne gebaseerde röntgenkleuring. Beide datasets werden verkregen met de Xradia Versa 500 microCT met behulp van identieke acquisitieparameters. De voxelgrootte in beide datasets is 13,5 m. (EEN, C en E) Overzichtsbeelden van de ongekleurde leverkwab van de muis die de weergaven langs de Cartesiaanse assen vertegenwoordigt. (B, D en F) Overzichtsbeelden van hetzelfde monster van de leverkwab van een muis in (A, C en E) na kleuring die de weergaven langs de cartesiaanse assen vertegenwoordigen. Anatomische structuren zoals het vaatstelsel worden gevisualiseerd. Credit: Wetenschappelijke rapporten , doi:https://doi.org/10.1038/s41598-018-36067-y.
Tijdens de eerste diagnose in de klinische pathologie, de celkernen en het cytoplasma zijn van belang. Bijna elk histologisch monster wordt daarom vaak gekleurd via het standaard hematoxyline en eosine (H&E) protocol om de kernen en het cytoplasma te identificeren. Maar standaarden voor de hematoxylinekleuring zijn niet vast en er bestaan veel varianten op het protocol vanwege verschillende weefseltypes en/of parameters voor de voorbehandeling. Als resultaat, Muller et al. introduceerde een hemateïne-gebaseerd kleuringsprotocol, speciaal ontwikkeld voor CT, om directe 3D-visualisatie van celkernen in monsters van zacht weefsel mogelijk te maken. Het krachtige potentieel van microCT of nanoCT in combinatie met kleurstoffen die geschikt zijn voor röntgenstralen, zal toekomstige inzichten in weefselorganisatie mogelijk maken om ziekten, waaronder osteoartritis en kanker, te begrijpen. bij de cellulaire nanoarchitectuur.
Bij het ontwikkelen van de nieuwe X-ray geschikt, hemateïne gebaseerde vlek, de veelgebruikte Mayer's hematoxyline en Wiegert's ijzerhematoxyline werden opgenomen in de grondwet. De kleuringsexperimenten werden uitgevoerd op het weefsel van de leverlobule van de muis, daarna gebruikt voor X-ray CT-beeldvorming. Het geoptimaliseerde kleuringsprotocol bevatte vijf stappen, te beginnen met gecontroleerde verzuring van monsters van zacht weefsel tijdens fixatie. Het zachte weefsel werd op moleculair niveau bereid om te kleuren met het hemateïne-lood(II)-complex.
In zijn werkingsmechanisme, de wetenschappers toonden een versterkte ionische interactie aan tussen het positief geladen hemateïne-lood(II)-complex en de negatief geladen fosfaatruggengraat van het deoxyribonucleïnezuur (DNA). De chemische reactie zorgde voor een hogere accumulatie van de kleurstof in de celkernen door de vorming van een hemateïne-lood(II)-DNA-complex, als een röntgen geschikt middel.

NanoCT-gegevens (A-C) in vergelijking met het histologische microscopische objectglaasje (D) afgeleid van dezelfde leverlobule van de muis na toepassing van het op hemateïne gebaseerde röntgenkleuringsprotocol. Duidelijke visualisatie van de grotere hepatocytcelkernen en de kleinere celkernen zoals Kupffer-cellen en SEC's in wit (A-C) of donkerpaars (D) en het BC-netwerk weergegeven in zwart (A-C) of wit (D) werd bereikt, respectievelijk. (A) het volume van belang (VOI) dat de twee nanoCT-segmenten benadrukt die worden weergegeven in (B, blauw kader) en (C, oranje kader). (B, C) representatieve individuele nanoCT-plakjes zoals aangegeven in de VOI van (A). (B) en (C) zijn orthogonaal ten opzichte van elkaar gepositioneerd. De oriëntatie van het BC-netwerk, die wordt gevormd door de hepatocyten wordt gezien, d.w.z. een meer horizontale opstelling is te zien in (B) en een meer verticale uitlijning in (C). De nanoCT-plakdikte is 580 nm. (D) Representatieve histologische microscopische glijbaan met een dikte van 3 m verkregen uit hetzelfde monster van de leverkwab van de muis na het aanbrengen van de hemateïne-gebaseerde vlek en het inbedden ervan in een paraffineblok. Credit: Wetenschappelijke rapporten , doi:https://doi.org/10.1038/s41598-018-36067-y.
Om de kleuringseffectiviteit te vergelijken, het leverkwabweefsel van de muis werd afgebeeld met microCT vóór kleuring, gevolgd door beeldvorming na hemateïne-protocol gebaseerde kleuring. Het kleuringsproces vond plaats in twee stappen en de gewenste contrastverbetering werd bereikt zoals verwacht na kleuring. De resultaten werden waargenomen met behulp van het microCT-overzicht om verschillende anatomische structuren te laten zien, inclusief het vaatstelsel. De kleuring was homogeen in de gehele leverlobule van de muis, in tegenstelling tot eerdere voorbeelden in grote leverweefselmonsters. Het 3D-beeldvormingsproces maakte toegang tot een reeks CT-plakjes in willekeurige vlakken mogelijk. Verder, in tegenstelling tot conventionele 2D-histologie (met in paraffine ingebed zacht weefsel), het zachte weefsel kan vanuit verschillende hoeken worden bekeken.
Het weefsel werd vervolgens op subcellulair niveau onderzocht met kleinere stukjes van dezelfde leverlobule, die werden ontleed en geanalyseerd met behulp van nanoCT. De gevisualiseerde resultaten toonden regio's van het volume van belang (VOI), celkernen van de hepatocyten en kernen van andere celtypen (Kupffer-cellen en sinusoïdale endotheelcellen). Zwarte hele structuren vertegenwoordigden het galcanaliculaire (BC) netwerk, terwijl de donkerdere grijze waarden het cytoplasma van het leverweefselmonster aangaven. De oriëntatie van het BC-netwerk werd ook waargenomen. Het weefsel werd vervolgens onderzocht met conventionele histologie, met behulp van zeer dunne microscopische objectglaasjes zonder andere kleuring dan de op hemateïne gebaseerde kleuring die is aangebracht. De conventionele techniek bevestigde op dezelfde manier de morfologie van hepatocyten en van andere celtypen (kernen gekleurd in donkerpaars), terwijl het BC-netwerk wit was gekleurd.
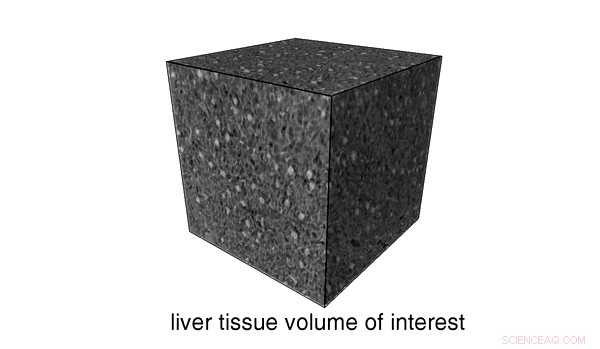
3D-kernen en analyse van verschillende celkernen die aanwezig zijn in het muislevervolume van belang (VOI). Credit: Wetenschappelijke rapporten , doi:https://doi.org/10.1038/s41598-018-36067-y.
De wetenschappers bevestigden de nauwkeurigheid van de 3D-gegevensreconstructie in het onderzoek met eerdere onderzoeken. Toen de op hemateïne gebaseerde procedure opnieuw werd toegepast in conventionele 2D-histologieonderzoeken, de wetenschappers pasten ook een standaard tegenkleuring toe, eosine Y specifiek, naar het celcytoplasma op het weefsel. Bij de resultaten, de celkernen bleven paars terwijl het cytoplasma de roze vlek opnam. Op deze manier, de wetenschappers authenticeerden ook de op kernen gebaseerde, op hemateïne gebaseerde kleuringscapaciteit met standaardhistologie.
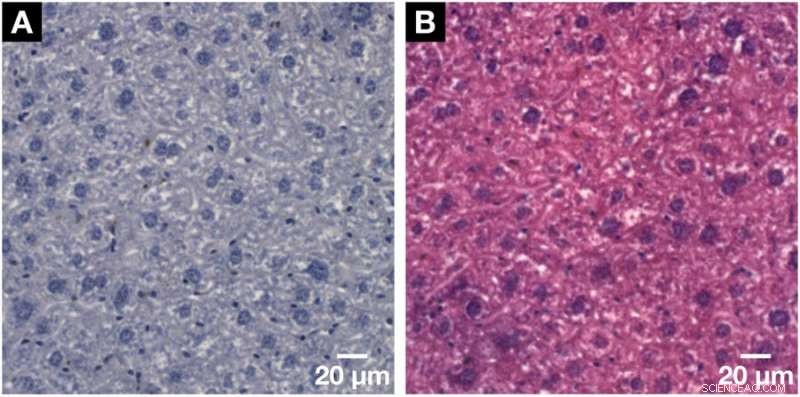
Demonstratie van de histologische compatibiliteit van de voor X-ray microCT en nanoCT ontwikkelde hemateïne-gebaseerde kleuringsmethode met conventionele 2D-histologie. (A) Representatieve histologische microscopische glijbaan met een dikte van 3 m verkregen uit hetzelfde monster van de leverkwab van de muis na de toegepaste hemateïne-gebaseerde kleuring en inbedding in een paraffineblok. Duidelijke visualisatie van de grotere hepatocytcelkernen en de kleinere celkernen zoals Kupffer-cellen en SEC's in donkerpaars en het BC-netwerk in wit weergegeven. (B) De compatibiliteit met de standaard tegenkleuring van eosine Y werd getoond op een volgende microscopische dia gezien in (A). De celkernen worden in paars weergegeven naast het cytoplasma in roze, wat resulteert in een typisch H&E-gekleurd microscopisch glaasje van een monster van zacht weefsel. Credit: Wetenschappelijke rapporten , doi:https://doi.org/10.1038/s41598-018-36067-y.
Het op hemateïne gebaseerde kleuringsprotocol hielp CT-visualisatie met hoge resolutie voor celkernen in zacht weefsel in het submicronbereik, tot nu toe niet mogelijk met andere kleurmethoden die werden gecombineerd met microCT-technologie. Toekomstige histopathologische onderzoeken kunnen mogelijk tijdrovende voorbereidingsprocedures en verlies van weefselmonsters elimineren (zoals gezien met standaardhistologie) om individuele weefselplakjes te verkrijgen via 3D-onderzoek van een volledige VOI, zoals aangetoond in de huidige studie. De mogelijkheid om een groter monster te screenen op abnormale celkernen zou pathologen kunnen helpen bij het identificeren van ontstekingsregio's om de etiologie en progressie van de ziekte te beoordelen.
Het kleuringsprotocol is eenvoudig en reproduceerbaar, geschikt voor CT-kleuring van hele organen, gekoppeld aan 3D-visualisatie en diepgaande, niet-destructieve analyse van monsters van zacht weefsel. De in het protocol vermelde kleurstoffen zijn gemakkelijk toegankelijk, terwijl het CT-gecombineerde röntgenprotocol een grotere verfijning mogelijk maakt voor analyses van weke delen. Stappen in het kleuringsprotocol vereisen verdere optimalisatie met verschillende weefseltypes en in diverse toepassingen, inclusief 3D histologie, ontwikkelings- en structurele biologiestudies in het laboratorium.
© 2018 Wetenschap X Netwerk
 Beter begrip van waterstofperoxideregulatie kan leiden tot nieuwe inzichten in ziekteontwikkeling
Beter begrip van waterstofperoxideregulatie kan leiden tot nieuwe inzichten in ziekteontwikkeling Cryo-elektronenmicroscopie bereikt ongekende resolutie met behulp van nieuwe rekenmethoden
Cryo-elektronenmicroscopie bereikt ongekende resolutie met behulp van nieuwe rekenmethoden Een droom voor strandliefhebbers:een stap in de richting van langdurige zonnebrandcrème
Een droom voor strandliefhebbers:een stap in de richting van langdurige zonnebrandcrème Simulaties laten zien hoe atomen zich gedragen in zelfherstellend cement
Simulaties laten zien hoe atomen zich gedragen in zelfherstellend cement Onderzoekers turbochargeren waterstofbrandstofcellen met nieuw ionengeleidend copolymeer
Onderzoekers turbochargeren waterstofbrandstofcellen met nieuw ionengeleidend copolymeer
Hoofdlijnen
- Native Plants & Animals of France
- Verschillen tussen Protista & Monera
- Chromosoomorganisatie komt voort uit 1-D-patronen
- Vijf olifanten gedood door trein in India
- Zijn psychische aandoeningen genetisch bepaald?
- Meiosis 1: Stadia & belang in celdeling
- Bacteriën levenscyclus
- Een boom die zichzelf bezit, groeit in Athene,
- Uitbreiding tonijnquota stap achteruit voor instandhouding
- Materialen met een speciaal soort grens tussen kristalkorrels kunnen op onverwachte manieren vervormen

- Op zoek naar steriele neutrino's
- Machine learning om de kwantumcomputer op te schalen

- Camouflage gemaakt van kwantummateriaal kan je verbergen voor infraroodcamera's

- De voortgang van fusie-energie volgen door 60 jaar neutrale deeltjesanalyse

 Hubble observeert klein sterrenstelsel met groot hart
Hubble observeert klein sterrenstelsel met groot hart Chelsea Manning en de opkomst van big data klokkenluiders in het digitale tijdperk
Chelsea Manning en de opkomst van big data klokkenluiders in het digitale tijdperk High-speed transistorkanaal ontwikkeld met behulp van een core-shell nanodraadstructuur
High-speed transistorkanaal ontwikkeld met behulp van een core-shell nanodraadstructuur Piek in gebruik van online communicatie-apps kan worden veroorzaakt door isolatie tijdens COVID-19
Piek in gebruik van online communicatie-apps kan worden veroorzaakt door isolatie tijdens COVID-19 Achtertuin niet achterlijk:opzettelijk leven, de opkomst van imikhukhu en stedelijke verdichting voor waardigheid
Achtertuin niet achterlijk:opzettelijk leven, de opkomst van imikhukhu en stedelijke verdichting voor waardigheid Schoonmaken van microscoopglaasjes
Schoonmaken van microscoopglaasjes Origami ontmoet chemie in wetenschappelijk videoartikel (met video)
Origami ontmoet chemie in wetenschappelijk videoartikel (met video) Hoe de molaire warmte van een verbrandingskaars te vinden
Hoe de molaire warmte van een verbrandingskaars te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

