
Wetenschap
Waarom zijn verbindingen goede isolatoren?
Hier is een uitsplitsing:
Waarom sommige verbindingen goede isolatoren zijn:
* Sterke covalente bindingen: Verbindingen met sterke covalente bindingen, zoals diamant of veel polymeren, hebben elektronen strak gebonden aan de atomen. Deze elektronen zijn niet vrij om te bewegen, waardoor de elektriciteitsstroom wordt voorkomen.
* Gap met grote band: De energie die nodig is om een elektron van de valentieband naar de geleidingsband te verplaatsen (waar het elektriciteit kan leiden) is in veel verbindingen hoog. Deze "band gap" maakt het voor elektronen moeilijk om voldoende energie te krijgen om vrij te worden en te leiden.
* Gebrek aan gratis ladingsdragers: Veel verbindingen hebben geen vrije elektronen of ionen die gemakkelijk elektrische stroom kunnen verplaatsen en dragen.
Waarom sommige verbindingen goede geleiders zijn:
* ionische verbindingen: Verbindingen met ionische bindingen hebben geladen ionen die vrij kunnen bewegen wanneer ze in water worden opgelost of gesmolten. Deze beweging zorgt voor de stroom van elektriciteit.
* metalen verbindingen: Metalen hebben een "zee van elektronen" waar elektronen losjes gebonden zijn en vrij kunnen bewegen, waardoor ze uitstekende geleiders zijn.
Voorbeelden:
* Goede isolatoren: Diamant, rubber, glas, plastic
* Goede dirigenten: Zout (NaCl), koper, goud
Conclusie wordt de elektrische geleidbaarheid van een verbinding bepaald door zijn chemische structuur, bindtype en de aanwezigheid van vrije ladingsdragers.
Het is belangrijk op te merken dat sommige verbindingen kunnen fungeren als halfgeleiders , wat betekent dat ze onder bepaalde omstandigheden elektriciteit kunnen leiden, maar niet andere. Dit komt door factoren zoals temperatuur, doping en onzuiverheden.
Hoofdlijnen
- Hoe waar mensen zijn uitgevonden?
- Wat bevatten eiwitten op elementair niveau?
- Wat is een synoniem voor massale uitsterven?
- Zou je het noemen wanneer organismen concurreren om biotische en abiotische factoren van een ecosysteem?
- Hoe spiercellen hun membranen afsluiten
- Worden enzymen gebruikt om suikersiroop zetmeelsiroop te draaien?
- Wat voor soort bacteriën veroorzaakt ziekte?
- Wanneer afscheid nemen? Enquête werpt licht op moeilijke beslissingen voor hondenbezitters
- Theory of Evolution: Definition, Charles Darwin, Evidence & Voorbeelden
- Nieuwe materialen kunnen wondgenezing stimuleren door gebruik te maken van natuurlijke genezingsmethoden

- Oppervlakte-oxygenaatsoorten verbeteren de door kobalt gekatalyseerde Fischer-Tropsch-synthese

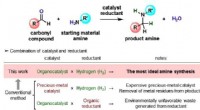
- Het naderen van een ideale aminozuursynthese met behulp van waterstof
- Activering met zichtbaar licht maakt transformatie van stabiele sulfonen naar waardevolle glycosiden mogelijk
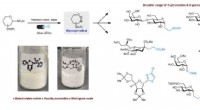
- Nanocontainers voor gerichte medicijnafgifte

 Hebben apen een uitscheidingssysteem?
Hebben apen een uitscheidingssysteem?  Is de zwaartekracht groter tijdens een volle maan?
Is de zwaartekracht groter tijdens een volle maan?  Onderzoekers combineren lasers en terahertz-golven in een camera die ongeziene details ziet
Onderzoekers combineren lasers en terahertz-golven in een camera die ongeziene details ziet Wetenschappers ontdekken waarom de Noordpool bevroren is
Wetenschappers ontdekken waarom de Noordpool bevroren is  Onderzoekers meten de bereidheid van kleinschalige vissers om vaartuigvolgsystemen te gebruiken
Onderzoekers meten de bereidheid van kleinschalige vissers om vaartuigvolgsystemen te gebruiken Fracties uitvoeren op een TI-30X IIS
Fracties uitvoeren op een TI-30X IIS  Een bepaling van de massa's en aantal molmolmijnen zwavelzuurstof in samengesteld dioxide?
Een bepaling van de massa's en aantal molmolmijnen zwavelzuurstof in samengesteld dioxide?  Is het waar of niet waar dat alle chemische reacties een initiële input van energie vereisen, genaamd katalyse?
Is het waar of niet waar dat alle chemische reacties een initiële input van energie vereisen, genaamd katalyse?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


