
Wetenschap
Wat is het kinetische moleculaire theorie -deeltjesmodel van een gas?
1. Gassen bestaan uit kleine deeltjes. Deze deeltjes worden beschouwd als puntmassa's met een verwaarloosbaar volume in vergelijking met de ruimte daartussen. Daarom zijn gassen zeer samendrukbaar.
2. De deeltjes zijn in constante willekeurige beweging. Ze bewegen in rechte lijnen totdat ze met elkaar of de containerwanden botsen. De botsingen zijn volkomen elastisch, wat betekent dat er geen energie verloren gaat tijdens de botsing.
3. Er zijn geen aantrekkelijke of afstotende krachten tussen gasdeeltjes. Dit houdt in dat de deeltjes onafhankelijk van elkaar bewegen, behalve tijdens botsingen.
4. De gemiddelde kinetische energie van de gasdeeltjes is recht evenredig met de absolute temperatuur. Dit betekent dat naarmate de temperatuur toeneemt, de deeltjes sneller bewegen en hogere kinetische energie hebben.
5. De druk van een gas wordt veroorzaakt door de botsingen van de gasdeeltjes met de wanden van de container. Hoe meer botsingen, hoe hoger de druk.
Implicaties van het KMT -model:
* Gasuitbreiding: De deeltjes zijn in constante beweging en verspreiden zich om de hele container te vullen.
* Gascompressibiliteit: De grote ruimtes tussen deeltjes zorgen voor een gemakkelijke compressie.
* diffusie: Deeltjes van verschillende gassen mengen gemakkelijk door hun willekeurige beweging.
* gasdruk: De druk komt voort uit de botsingen van gasdeeltjes met de containerwanden.
* Ideale gaswet: Het KMT -model biedt een basis voor de ideale gaswet, die druk, volume, temperatuur en het aantal mol van een gas relateert.
Beperkingen van het KMT -model:
* Echte gassen wijken af van ideaal gedrag bij hoge drukken en lage temperaturen. Dit komt omdat intermoleculaire krachten onder deze omstandigheden aanzienlijk worden.
* Het model houdt geen rekening met de complexe interacties tussen deeltjes, zoals van der Waals -krachten.
Ondanks zijn beperkingen is het KMT -model een krachtig hulpmiddel om het gedrag van gassen te begrijpen en een breed scala aan fenomenen te verklaren.
 Wat zijn de factoren die specifieke latente fusiewarmte beïnvloeden, een stof?
Wat zijn de factoren die specifieke latente fusiewarmte beïnvloeden, een stof?  Geef twee voorbeelden van een stoffen die oplosbaar zijn in water?
Geef twee voorbeelden van een stoffen die oplosbaar zijn in water?  Hoe is oplosbaarheid gerelateerd aan temperatuur?
Hoe is oplosbaarheid gerelateerd aan temperatuur?  Vraag ons ietsWelke van de volgende bevat een niet-polaire covalente binding?
Vraag ons ietsWelke van de volgende bevat een niet-polaire covalente binding?  Hoe worden de niet-natuurlijke elementen van het periodieke tabel genoemd?
Hoe worden de niet-natuurlijke elementen van het periodieke tabel genoemd?
Hoofdlijnen
- Zou een bioloog die de details van eiwitmoleculen op oppervlaktecel bestudeert, zou ze waarschijnlijk een?
- Een win-win voor gevlekte uilen en bosbeheer
- Wat maakt de mens menselijk?
- Sprinten richting uitsterven? Het aantal cheetahs daalt wereldwijd
- Wat is de naam van een plant die Fibonacci -nummers toont in aantal groeipunten die het heeft?
- Hoe een organisme zijn interne lichaamsomstandigheden behoudt, zoals temperatuur en hoeveelheid watervoedingsstoffen?
- Ontdekking van oud glasvezelfossiel uit Glasgow onthult nieuwe soorten
- Antibioticaresistentie:onderzoekers slagen erin resistentiegenen te blokkeren
- Hoe transformeren kleine boeren in Noord-China naar duurzame productie?
- Licht schijnend op recombinatiemechanismen in zonnecelmaterialen
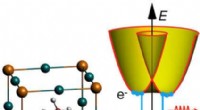
- Team ontwikkelt een elektrochemische methode om uranium te winnen, en mogelijk andere metaalionen, van oplossing
- Koolstofneutrale brandstoffen komen een stap dichterbij

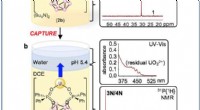
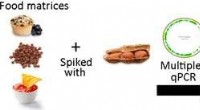
- Op DNA gebaseerde methode detecteert sporen van pinda's in voedingsmiddelen
- De weg verlichten om van chemische reactiepaden te wisselen

 Waar wordt Phyllite voor gebruikt?
Waar wordt Phyllite voor gebruikt?  Heeft Soylent Green 2022 goed gekregen?
Heeft Soylent Green 2022 goed gekregen? Paleontologen melden 's werelds grootste Tyrannosaurus rex
Paleontologen melden 's werelds grootste Tyrannosaurus rex Welk gas wordt afgegeven wanneer fossiele brandstoffen verbranden?
Welk gas wordt afgegeven wanneer fossiele brandstoffen verbranden?  China wordt 's werelds grootste octrooiaanvrager:UN
China wordt 's werelds grootste octrooiaanvrager:UN Welke planten zijn nauw verwant aan marihuana?
Welke planten zijn nauw verwant aan marihuana?  Op welke 2 dingen is het moment van een kracht afhankelijk?
Op welke 2 dingen is het moment van een kracht afhankelijk?  Oude mensen jaagden 12.000 jaar geleden op uitgestorven olifanten bij het Tagua Tagua-meer in Chili
Oude mensen jaagden 12.000 jaar geleden op uitgestorven olifanten bij het Tagua Tagua-meer in Chili
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

