
Wetenschap
Wat is de KSP voor zilvercarbonaat AG2CO3 als ionenconcentratie in een verzadigde oplossing 0,00026 m?
KSP begrijpen
* ksp (oplosbaarheid productconstante): KSP is de evenwichtsconstante voor het oplossen van een spaarzaam oplosbare ionische verbinding. Het vertegenwoordigt het product van de ionenconcentraties die zijn verhoogd tot hun stoichiometrische coëfficiënten in een verzadigde oplossing.
Het oplossing -evenwicht
Ag₂co₃ (s) ⇌ 2ag⁺ (aq) + co₃²⁻ (aq)
het berekenen van KSP
1. Identificeer de stoichiometrische coëfficiënten: In de evenwichtige vergelijking worden 2 mol Ag⁺ -ionen geproduceerd voor elke 1 mol co₃²⁻ ionen.
2. Schrijf de KSP -uitdrukking:
KSP =[Ag⁺] ² [Co₃²⁻]
3. Vervang de gegeven concentratie:
* [Ag⁺] =0,00026 m
* Omdat de concentratie van Ag⁺ tweemaal de concentratie van co₃²⁻ is, [co₃²⁻] =0,00026 m / 2 =0,00013 m
4. Bereken ksp:
KSP =(0,00026) ² (0,00013)
KSP =8,79 x 10⁻¹²
Daarom is de KSP voor zilvercarbonaat (Ag₂co₃) ongeveer 8,79 x 10⁻¹²
 Waarom neemt de oplosbaarheid van lithiumcarbonaat af naarmate de temperatuur stijgt?
Waarom neemt de oplosbaarheid van lithiumcarbonaat af naarmate de temperatuur stijgt?  Is verdunning de toevoeging van opgeloste stof om het oplosmiddel van het concentratie te verminderen?
Is verdunning de toevoeging van opgeloste stof om het oplosmiddel van het concentratie te verminderen?  Wat zijn de actieve ingrediënten in roestvrij staal?
Wat zijn de actieve ingrediënten in roestvrij staal?  Hoe kan water veranderen in gas?
Hoe kan water veranderen in gas?  Hoeveel verschillende substituenten zijn er nodig op een koolstofatoom om chiraal te zijn?
Hoeveel verschillende substituenten zijn er nodig op een koolstofatoom om chiraal te zijn?
 Waarom komt het sneeuwpakket van Colorado niet in de Colorado-rivier terecht? Uit onderzoek blijkt dat dit mogelijk te maken heeft met een gebrek aan regenval in de lente
Waarom komt het sneeuwpakket van Colorado niet in de Colorado-rivier terecht? Uit onderzoek blijkt dat dit mogelijk te maken heeft met een gebrek aan regenval in de lente  Uitlegger:Hoeveel koolstof kunnen de bossen in de wereld absorberen?
Uitlegger:Hoeveel koolstof kunnen de bossen in de wereld absorberen?  Expeditie wil ontdekken hoe smeltend ijs de aanvoer van voedingsstoffen in de zee beïnvloedt
Expeditie wil ontdekken hoe smeltend ijs de aanvoer van voedingsstoffen in de zee beïnvloedt Chemische neuzen om verontreinigende stoffen op te sporen en te verwijderen
Chemische neuzen om verontreinigende stoffen op te sporen en te verwijderen Opwarming van de aarde verandert het Great Barrier Reef
Opwarming van de aarde verandert het Great Barrier Reef
Hoofdlijnen
- Welk afvalproduct wordt door bloed uit cellen opgehaald?
- Wat laat bepaalde materialen in en uit de cel passeren?
- Waarom zijn abiotische factoren belangrijk voor het overleven van biotic in een ecosysteem?
- Woont een biosfeergroep van hetzelfde type organisme op zijn plaats en tijd?
- Welke waarnemingen zijn er in de jaren sinds het voorstel voor een celmembraan met vloeibaar mozaïekmodel toegevoegd?
- Wat is erpsin -enzym?
- Bootverkeer bedreigt het voortbestaan van de Bocas Del Toro-dolfijnen in Panama
- De genen van kinderen beïnvloeden hoe goed zij profiteren van onderwijs
- Wat beïnvloedt een Trait Expression de meeste, genetica of de omgeving?
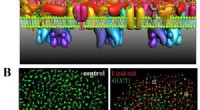
- Beeldvorming met superresolutie onthult het mechanisme van GLUT1-clustering
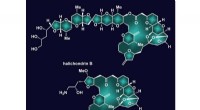
- Omkering versnelt creatie van belangrijk molecuul:Lab maakt synthese van halichondrine B efficiënter
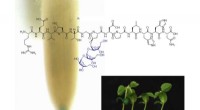
- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
- Oostenrijkse onderzoekers vergemakkelijken de analyse van lipidegegevens
- Wetenschappers ontdekken dat hydratatie de sleutel is tot het verbeteren van de prestaties van katalysatoren voor industrieel gebruik
 China lanceert eerste heavy-lift raket
China lanceert eerste heavy-lift raket Hoeveel valentie-elektronen heeft cl-?
Hoeveel valentie-elektronen heeft cl-?  Hoe verander je 7,6 centimeter in millimeters?
Hoe verander je 7,6 centimeter in millimeters?  Hoe geeft Twitter vorm aan het gesprek rond COVID-19?
Hoe geeft Twitter vorm aan het gesprek rond COVID-19? Planten in een koraalrif
Planten in een koraalrif  Heel veel nullen:Apple Music overschrijdt 100 miljoen songbarrière
Heel veel nullen:Apple Music overschrijdt 100 miljoen songbarrière Waarom wordt bodembelasting alleen aangetroffen in bergbeken met een hoge hellingsgraad?
Waarom wordt bodembelasting alleen aangetroffen in bergbeken met een hoge hellingsgraad?  Oceaancirculatie is de sleutel tot het begrijpen van onzekerheden in voorspellingen van klimaatverandering
Oceaancirculatie is de sleutel tot het begrijpen van onzekerheden in voorspellingen van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

