
Wetenschap
Waarom is regenwater zuur maar oceaanwaterbasis?
regenwater:
* Natuurlijke zuurgraad: Puur regenwater is enigszins zuur vanwege opgeloste koolstofdioxide (CO2) uit de atmosfeer. CO2 reageert met water om koolzuur te vormen (H2CO3), wat resulteert in een pH van ongeveer 5,6.
* zure regen: Menselijke activiteiten, zoals het branden van fossiele brandstoffen, geven zwaveldioxide (SO2) en stikstofoxiden (NOx) in de atmosfeer vrij. Deze gassen reageren met water om respectievelijk zwavelzuur (H2SO4) en salpeterzuur (HNO3) te vormen, waardoor regenwater zuurder wordt. Dit staat bekend als zure regen en het kan schadelijke effecten op het milieu hebben.
oceaanwater:
* opgeloste zouten: Oceaanwater bevat hoge niveaus van opgeloste zouten, waaronder natriumchloride (NaCl), magnesiumchloride (MGCL2) en calciumsulfaat (CASO4). Deze zouten dragen bij aan de enigszins eenvoudige pH van oceaanwater.
* carbonaatbuffersysteem: De oceaan bevat een natuurlijk buffersysteem op basis van de interactie van carbonzuur, bicarbonaationen (HCO3-) en carbonaationen (CO32-). Dit systeem helpt om veranderingen in de pH te matigen, waardoor de oceaan relatief stabiel blijft.
* Biologische processen: Mariene organismen, zoals koralen, algen en fytoplankton, release calciumcarbonaat (CACO3), die bijdragen aan de alkaliteit van oceaanwater.
Samenvattend:
* regenwater: Iets zuur als gevolg van opgeloste CO2 en zure regen.
* oceaanwater: Iets eenvoudig als gevolg van opgeloste zouten, een carbonaatbuffersysteem en biologische processen.
Het is belangrijk op te merken dat zowel regenwater als oceaanwater een smal pH -bereik hebben, wat betekent dat ze niet extreem zuur of basic zijn. Veranderingen in de zuurgraad of alkaliteit van beide kunnen echter aanzienlijke milieueffecten hebben.
 Hoe scheid je een mengsel van houtskool van zout?
Hoe scheid je een mengsel van houtskool van zout?  Hoe gehoorzaamt zuurstof de Octect -regel bij het reageren om verbindingen te vormen?
Hoe gehoorzaamt zuurstof de Octect -regel bij het reageren om verbindingen te vormen?  Hoe te testen op kaliumjodide
Hoe te testen op kaliumjodide
Wetenschappers verwijzen naar chemische testen die de aanwezigheid of afwezigheid van bepaalde chemische soorten bevestigen als 'kwalitatieve analyse'. Dergelijke tests vormen de basis van een aantal niet-gegradueerde
 Hoe wordt een gecoördineerde binding gevormd?
Hoe wordt een gecoördineerde binding gevormd?  Ingenieurs vinden dat antioxidanten de visualisatie van polymeren op nanoschaal verbeteren
Ingenieurs vinden dat antioxidanten de visualisatie van polymeren op nanoschaal verbeteren
 Wetenschappers bestuderen vissen om te leren hoe ze de gevolgen van klimaatverandering kunnen aanpassen
Wetenschappers bestuderen vissen om te leren hoe ze de gevolgen van klimaatverandering kunnen aanpassen  Onderzoek naar koolstofcycli in bosbodems gepresenteerd
Onderzoek naar koolstofcycli in bosbodems gepresenteerd Zijn veel voorkomende organismen die op rots groeien en verwering veroorzaken?
Zijn veel voorkomende organismen die op rots groeien en verwering veroorzaken?  Hoe kwam de aarde aan haar water?
Hoe kwam de aarde aan haar water?  Te midden van landelijke droogte, Rome zoekt naar manieren om rantsoenering te vermijden
Te midden van landelijke droogte, Rome zoekt naar manieren om rantsoenering te vermijden
Hoofdlijnen
- Studie:Lagunes van de vergeten kust van de Noordpool kwetsbaar voor klimaatverandering en menselijke ontwikkeling
- Wat is de manier van overerving -syndroom?
- Wat is de wetenschappelijke gemeenschappelijke naam voor gastro -intestinale ziekte?
- Waarom zijn mannelijke muizen bang voor bananen?
- Wat zijn wetenschappelijke woorden die beginnen met AB?
- Wie is de vader van moderne organismeclassificatie?
- Hoe je een structuur kunt laten groeien met 'champignonworstjes'
- Twilight-truc:er is een nieuw type cel gevonden in het oog van een diepzeevis
- Jonge vleermuizen leren vleermuisdialecten van hun nestgenoten
- Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen

- Onderzoek onthult kwantitatieve en hoge-resolutie drukfuncties van drukgevoelig materiaal
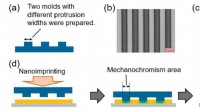
- Meerlagige fabricage op wafelschaal van micro-elektronica op basis van zijdefibroïne

- Een radicaal gebruiken om CF-bindingen één voor één te verbreken
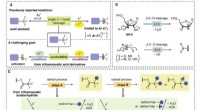
- Reductie zorgt voor schonere en efficiëntere katalytische reacties

 Is een rollende marmeren kinetische of potentiële energie?
Is een rollende marmeren kinetische of potentiële energie?  Zijn moleculen rechtshandig of linkshandig? Eigenschappen van chiraal op attosecondeniveau
Zijn moleculen rechtshandig of linkshandig? Eigenschappen van chiraal op attosecondeniveau  Hoe creëer je energie?
Hoe creëer je energie?  Science Projects on Snails
Science Projects on Snails Welk massacummer of atoom bepaalt welk element een atoom is?
Welk massacummer of atoom bepaalt welk element een atoom is?  Consortium onderzoekt nieuwe manieren om arseen in koperconcentraten te verminderen
Consortium onderzoekt nieuwe manieren om arseen in koperconcentraten te verminderen De dynamiek van elektron-licht-interactie demonstreren die voortkomt uit het eerste principe
De dynamiek van elektron-licht-interactie demonstreren die voortkomt uit het eerste principe Wetenschappers bieden bedrijven een nieuwe chemie voor groener polyurethaan
Wetenschappers bieden bedrijven een nieuwe chemie voor groener polyurethaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

