
Wetenschap
Waarom zijn de elektronen in een binding tussen koolstof en zuurstof dichter bij atoom dan atoom?
* elektronegativiteit: Zuurstof is elektronegatiefer dan koolstof. Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding. Zuurstof heeft een hogere elektronegativiteitswaarde (3,44) dan koolstof (2,55). Dit betekent dat zuurstof een sterkere trek heeft op de gedeelde elektronen in de binding.
* polariteit: De ongelijke delen van elektronen als gevolg van het elektronegativiteitsverschil creëert een polaire covalente binding . Het zuurstofatoom wordt enigszins negatief geladen (Δ-) omdat het de elektronen sterker aantrekken, terwijl het koolstofatoom enigszins positief wordt geladen (δ+).
* Elektronendichtheid: Door de hogere elektronendichtheid rond het zuurstofatoom lijken het alsof de elektronen er dichterbij zijn.
Samenvattend: De elektronen in een koolstofoxygenbinding liggen dichter bij het zuurstofatoom omdat de sterkere elektronegativiteit van zuurstof de gedeelde elektronen naar zichzelf trekt, waardoor een polaire covalente binding ontstaat.
 Wat is de functie van waterstoffluoride?
Wat is de functie van waterstoffluoride?  Waarom heeft H2O een hoger punt dan CO2?
Waarom heeft H2O een hoger punt dan CO2?  Innovatieve technieken voor DNA-herstel kunnen slachtoffers helpen verkrachters in Kenia te pakken
Innovatieve technieken voor DNA-herstel kunnen slachtoffers helpen verkrachters in Kenia te pakken Het aantal neutronen, protonen en elektronen voor atomen, ionen en isotopen vinden
Het aantal neutronen, protonen en elektronen voor atomen, ionen en isotopen vinden Wat is de evenwichtige vergelijking voor koper 2 broom?
Wat is de evenwichtige vergelijking voor koper 2 broom?
 Californië complotteert om AWOL Trump te bestrijden over klimaat
Californië complotteert om AWOL Trump te bestrijden over klimaat Waarom maakt uw locatie op aarde een verschil in hoeveel hitte u van de zon krijgt?
Waarom maakt uw locatie op aarde een verschil in hoeveel hitte u van de zon krijgt?  Is er al een groot ijzerbemestingsexperiment aan de gang?
Is er al een groot ijzerbemestingsexperiment aan de gang? Wat maakt alle observaties en antwoorden in de wetenschap geldig?
Wat maakt alle observaties en antwoorden in de wetenschap geldig?  Waarom is fytoplankton belangrijk?
Waarom is fytoplankton belangrijk?
Hoofdlijnen
- Hoe beschadigt UV-licht de DNA-streng?
- De eerste blik op hoe hondsdolheid het sociale gedrag van vampiervleermuizen beïnvloedt
- Hoe heet een wetenschapper die planten bestudeert?
- Onderzoekers detecteren signalen van parasieten in mest van amfibieën
- Welke verandering zou je in dode organismen in de loop van de tijd verwachten?
- De evolutie van taal? Daar is een app voor
- Computermodellen leggen uit hoe dieren acties selecteren met lonende resultaten
- Wilde dieren vormen grote bedreiging voor Outback, klimaatverandering studie vindt
- Evolutionaire geschiedenis vormt variatie in houtdichtheid:studie
- Functionaliseren van niet-geactiveerde alkanen met behulp van reacties op basis van katalysatoren gemaakt van meer overvloedige materialen
- Wetenschappers ontwikkelen methode om fluorescerende biosensoren te testen voordat ze worden gesynthetiseerd

- Moleculaire simulaties laten zien hoe medicijnen belangrijke receptoren blokkeren

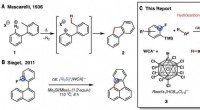
- Lithium-magnesium alkyl-alkoxy tussenproducten in Br-Mg uitwisseling
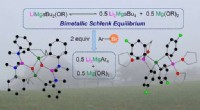
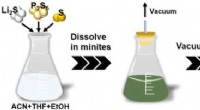
- Ontwikkeling van een nieuwe grootschalige productietechnologie voor sulfide vaste elektrolyten
 Wat lazen de astronauten voor het eerst dat ze de maan baanden?
Wat lazen de astronauten voor het eerst dat ze de maan baanden?  Townships en secties zoeken op een kaart
Townships en secties zoeken op een kaart  Wat zijn de lagen van gassen rond de aarde?
Wat zijn de lagen van gassen rond de aarde?  Waarom worden vloeistoffen gebruikt in hydraulica in plaats van gassen?
Waarom worden vloeistoffen gebruikt in hydraulica in plaats van gassen?  Wat is de pH van een Indegestion -tablet?
Wat is de pH van een Indegestion -tablet?  Hoe train je de snelheid van een bewegende auto?
Hoe train je de snelheid van een bewegende auto?  Hoe beïnvloedt de natuurlijke selectie polygene eigenschappen?
Hoe beïnvloedt de natuurlijke selectie polygene eigenschappen?  Onderzoekers onderzoeken het gebruik van licht om schijven in de mesosfeer te laten zweven
Onderzoekers onderzoeken het gebruik van licht om schijven in de mesosfeer te laten zweven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

