
Wetenschap
Waarom is rooster energie van NaCl groter dan KCL en KBR?
1. Kleinere ionische grootte:
* Natrium (Na+) is kleiner dan kalium (k+) en bromide (br-) is groter dan chloor (Cl-).
* Kleinere ionen trekken elkaar sterker aan vanwege de nadere nabijheid van hun kosten.
* Deze sterkere elektrostatische aantrekkingskracht leidt tot hogere roosterergie.
2. Hogere ladingsdichtheid:
* Natrium (Na+) heeft een hogere ladingsdichtheid in vergelijking met kalium (k+) omdat het dezelfde lading heeft maar kleiner.
* Hogere ladingsdichtheid betekent een sterkere aantrekkingskracht tussen de ionen, wat bijdraagt aan hogere roosterergie.
3. Groter elektronegativiteitsverschil:
* Het elektronegativiteitsverschil tussen natrium (NA) en chloor (CL) is groter dan tussen kalium (K) en chloor (CL) of kalium (K) en broom (BR).
* Een groter elektronegativiteitsverschil betekent een meer ionisch karakter in de binding, wat leidt tot een sterkere elektrostatische aantrekkingskracht en hogere roosterergie.
Samenvattend:
De combinatie van kleinere ionische grootte, hogere ladingsdichtheid en groter elektronegativiteitsverschil in NaCl resulteert in sterkere elektrostatische interacties en een hogere roosterergie in vergelijking met KCL en KBR.
 Hebben de producten in een chemische reactie dezelfde prerties als reactanten?
Hebben de producten in een chemische reactie dezelfde prerties als reactanten?  Welke eigenschappen van jodium Xenon en Selenium worden aangegeven door hun posities in het periodiek systeem?
Welke eigenschappen van jodium Xenon en Selenium worden aangegeven door hun posities in het periodiek systeem?  Wat is de grondstof van fotosynthese?
Wat is de grondstof van fotosynthese?  Wat is het verschil tussen koolstofstaal op lage temperatuur en waterstofstaal?
Wat is het verschil tussen koolstofstaal op lage temperatuur en waterstofstaal?  Licht pincet kan bewegen, smelten, en verstrooi mysterieuze biologische ijsbergen
Licht pincet kan bewegen, smelten, en verstrooi mysterieuze biologische ijsbergen
 Beschouwingen over COVID-19 en onze vernietiging van de natuur
Beschouwingen over COVID-19 en onze vernietiging van de natuur Zware regenval teistert Sydney, chaos veroorzaken
Zware regenval teistert Sydney, chaos veroorzaken Simple Photosynthesis Activities
Simple Photosynthesis Activities Satelliet vangt nachtelijke opname van grote orkaan Teddy
Satelliet vangt nachtelijke opname van grote orkaan Teddy Warme periodes in januari, bevriezing in maart:hoe planten omgaan met de verschuiving van winter naar lente
Warme periodes in januari, bevriezing in maart:hoe planten omgaan met de verschuiving van winter naar lente
Hoofdlijnen
- Wat breekt complexe suikers in eenvoudige en eiwitten tot aminozuren?
- Kan e-learning de dreiging van invasieve uitheemse soorten zoals de Japanse duizendknoop helpen tegengaan?
- Nieuw onderzoek laat zien hoe meer boeren kunnen worden betrokken bij het ontwerpen van nieuw milieubeleid
- Team ontwikkelt technologie voor de productie van bioplastics uit landbouw- en voedselbijproducten
- Onderzoekers ontdekken hoe gelei-zeedieren moderne robotica kunnen vormen
- Het oorsprongsverhaal van de baobab uitpakken
- Is voet biotisch of abioitisch?
- Is het lichaam samengesteld uit atomen of cel?
- Een andere massale verblekingsgebeurtenis verwoest het Great Barrier Reef. Wat is er nodig om koraal te laten overleven?
- Unieke medicijnstructuren vinden met kunstmatige intelligentie en chemie

- Wetenschappers ontdekken bindend geheim achter eiwitsuperlijm
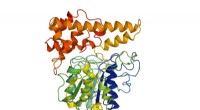
- Het blootleggen van een sleutelmechanisme in de assemblage van het aviaire sarcoomvirus, een 100 jaar oud oncogeen virus dat vaak wordt gebruikt om hiv-1 te bestuderen
- Krachtige laserdiodes kunnen restspanning in 3D-geprinte metalen onderdelen verminderen

- Simulatie op atoomschaal van antiaritmische geneesmiddelinteractie met hartcellen

 Wat zijn de kenmerken van blad- en uiencellen van wangcellen?
Wat zijn de kenmerken van blad- en uiencellen van wangcellen?  Nieuwe exotische magnetische quasideeltjes skyrmion-bundel voegt zich bij topologische dierentuin
Nieuwe exotische magnetische quasideeltjes skyrmion-bundel voegt zich bij topologische dierentuin Nieuwe emissietests verlagen Duitse autoverkoop in september
Nieuwe emissietests verlagen Duitse autoverkoop in september Welke chemische formule krijgt u bij het mengen van koper en aluminium?
Welke chemische formule krijgt u bij het mengen van koper en aluminium?  Heeft Cassini bij Titan een universele driver voor prebiotische chemie gevonden?
Heeft Cassini bij Titan een universele driver voor prebiotische chemie gevonden? Welk orgaansysteem is grotendeels verantwoordelijk voor het genereren van gedrag bij meercellige dieren?
Welk orgaansysteem is grotendeels verantwoordelijk voor het genereren van gedrag bij meercellige dieren?  Voorspelling van het lot van olielozingen in Arctisch zee-ijs
Voorspelling van het lot van olielozingen in Arctisch zee-ijs Wat zijn enkele ruimtetools en apparaten?
Wat zijn enkele ruimtetools en apparaten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

