
Wetenschap
Welke eigenschappen van jodium Xenon en Selenium worden aangegeven door hun posities in het periodiek systeem?
jodium (i)
* Groep 17 (halogenen): Jodium is een halogeen, wat betekent dat het zeven valentie -elektronen heeft en de neiging heeft om één elektron te krijgen om een stabiel octet te bereiken. Dit maakt het zeer reactief en zal waarschijnlijk negatieve ionen (anionen) vormen.
* Periode 5: Jodium is in de vijfde periode, wat aangeeft dat het vijf elektronenschalen heeft. Dit leidt tot grotere atoomgrootte in vergelijking met lichtere halogenen zoals fluor en chloor.
* niet -metaal: Jodium is een niet -metaal, wat betekent dat het metaalkenmerken mist, zoals geleidbaarheid en kneedbaarheid. Het bestaat als een vaste stof bij kamertemperatuur en heeft een karakteristieke paarse damp.
xenon (xe)
* Groep 18 (edelgassen): Xenon is een edelgas, wat betekent dat het een volledige buitenste schaal van elektronen heeft (acht valentie -elektronen). Dit maakt het uitzonderlijk niet -reactief en stabiel.
* Periode 5: Net als jodium heeft Xenon vijf elektronenschalen, wat bijdraagt aan de grotere atoomgrootte in vergelijking met lichtere edelgassen.
* niet -metaal: Xenon is een niet -metaal, bestaande als een kleurloos, geurloos gas bij kamertemperatuur. Het staat bekend om zijn interessante luminescentie -eigenschappen.
selenium (SE)
* Groep 16 (Chalcogens): Selenium is een chalcogeen, met zes valentie -elektronen. Het heeft de neiging om twee elektronen te krijgen om stabiele anionen te vormen.
* Periode 4: Selenium heeft vier elektronenschalen, waardoor het kleiner is dan jodium en xenon, maar groter dan lichtere chalcogenen zoals zuurstof en zwavel.
* Metalloid: Selenium is een metalloïde, wat betekent dat het eigenschappen van zowel metalen als niet -metalen vertoont. Het is een halfgeleider en heeft wat metalen glans.
Samenvatting van eigenschappen
* Reactiviteit: Halogenen (jodium) zijn reactief, terwijl edelgassen (xenon) niet -reactief zijn. Chalcogenen (selenium) hebben matige reactiviteit.
* Atomaire maat: Elementen binnen een groepsverhoging van de atoomgrootte terwijl u door het periodiek systeem gaat. Jodium en xenon zijn dus groter dan selenium.
* Metallic teken: Halogenen en edelgassen zijn niet -metalen, terwijl selenium een metalloïde is.
Laat het me weten als je meer details wilt over een specifiek eigendom of aspect van hun chemie!
 Nanoporeuze materiaalnetten verontreinigende stoffen uit water
Nanoporeuze materiaalnetten verontreinigende stoffen uit water Hoe beschrijft een moleculaire formule verbinding?
Hoe beschrijft een moleculaire formule verbinding?  Wat zou je gebruiken om een gas te testen om te zien of het waterdamp is?
Wat zou je gebruiken om een gas te testen om te zien of het waterdamp is?  Hoe beweegt het gasdrijfgas bij gebruik van een spuitbus?
Hoe beweegt het gasdrijfgas bij gebruik van een spuitbus?  Startup schaalt koolstof nanobuismembranen op om koolstofvrije brandstoffen te maken voor minder dan fossiele brandstoffen
Startup schaalt koolstof nanobuismembranen op om koolstofvrije brandstoffen te maken voor minder dan fossiele brandstoffen
 Te gek? Water verplaatsen van overstroming naar droogte
Te gek? Water verplaatsen van overstroming naar droogte  Geef orkanen niet de schuld van de meeste grote stormvloeden in het noordoosten
Geef orkanen niet de schuld van de meeste grote stormvloeden in het noordoosten Nieuwe online tool om bewoners te helpen de impact van verkeersgerelateerde luchtvervuiling te verminderen
Nieuwe online tool om bewoners te helpen de impact van verkeersgerelateerde luchtvervuiling te verminderen Een groot probleem:Florida zet zich schrap voor orkaan Dorian
Een groot probleem:Florida zet zich schrap voor orkaan Dorian Onderzoekers onderzoeken hoe klimaatverandering vogels beïnvloedt
Onderzoekers onderzoeken hoe klimaatverandering vogels beïnvloedt
Hoofdlijnen
- Wat zou er gebeuren als de cellen die het gevolg zijn van mitose een volledige set chromosomen hadden in plaats van de helft?
- Nieuw onderzoek onthult aanwijzingen over hoe antilichamen verfijnd worden om infecties te bestrijden
- Hoe mannelijke muggen compenseren voor het hebben van slechts één X-chromosoom
- Biologen ontdekken hoe virussen de machinerie van cellen kapen
- 3D-röntgentechnologie gebruiken voor de detectie van illegale handel in wilde dieren
- Onderzoek toont aan hoe kunststoffen de biodiversiteit van het zeeleven bedreigen
- Tropische insecten zijn extreem gevoelig voor veranderende klimaten
- Van welke delen van de wereld komen wetenschappers vandaan?
- Hoe bekritiseer je iets zonder een eikel te zijn?
- Nieuwe bio-geïnspireerde lijm hecht elk oppervlak onder water

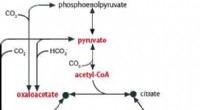
- Ontdekking van een oermetabolisch systeem dat ons een glimp geeft van de oorsprong van het leven op aarde
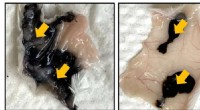
- Een verbeterde inkt voor colon-tatoeages
- Oorsprong van het leven:het belang van interfaces

- Haat-liefdeverhouding tussen oplosmiddel en water leidt tot een betere afbraak van biomassa

 Als mensen inkrimpen tot tiny houses, ze nemen een milieuvriendelijkere levensstijl aan
Als mensen inkrimpen tot tiny houses, ze nemen een milieuvriendelijkere levensstijl aan Wat is de bruine draad in een stekker?
Wat is de bruine draad in een stekker?  Deskundigen onderzoeken hoe orde uit chaos ontstaat
Deskundigen onderzoeken hoe orde uit chaos ontstaat  Wat is de juiste naam voor neerslag gevormd bij het mengen van kaliumcarbonaat en nikkel (II) chloride?
Wat is de juiste naam voor neerslag gevormd bij het mengen van kaliumcarbonaat en nikkel (II) chloride?  Hoe hangen frequentie en golflengte van licht samen?
Hoe hangen frequentie en golflengte van licht samen?  De Amerikaanse toeleveringsketen was een tikkende tijdbom:hoe deze weer op te bouwen
De Amerikaanse toeleveringsketen was een tikkende tijdbom:hoe deze weer op te bouwen Hoe bestudeerden mensen de hogere atmosfeer voordat er vliegtuigen en andere geavanceerde instrumenten bestonden?
Hoe bestudeerden mensen de hogere atmosfeer voordat er vliegtuigen en andere geavanceerde instrumenten bestonden?  Klimaatverandering betekent langer opstijgen en minder passagiers per vliegtuig
Klimaatverandering betekent langer opstijgen en minder passagiers per vliegtuig
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

