
Wetenschap
Hoe beïnvloedt temperatuur de pH van de natriumfosfaatoplossing?
Inzicht in de basis:
* Natriumfosfaat (NA3PO4) is een zout van een zwak zuur (H3PO4) en een sterke basis (NaOH). Dit betekent dat de oplossingen meestal enigszins basic zijn (pH> 7).
* De pH van een oplossing is een maat voor zijn waterstofion (H+) concentratie.
Temperatuur en pH:
* Naarmate de temperatuur toeneemt, neemt de ionisatie van water toe. Dit betekent dat er meer H+ -ionen worden vrijgegeven, wat leidt tot een lichte afname van de pH (d.w.z. de oplossing iets zuurder maken).
* De ionisatie van het zwakke zuur (H3PO4) neemt ook toe met temperatuur. Dit geeft meer H+ -ionen vrij en draagt verder bij aan een lichte afname van de pH.
Belangrijkste overwegingen:
* Het effect van temperatuur op de pH is relatief klein voor natriumfosfaatoplossingen. De primaire factor die de pH beïnvloedt, is de concentratie van de oplossing, niet de temperatuur.
* De specifieke verandering in pH met temperatuur hangt af van de initiële concentratie van de natriumfosfaatoplossing en het temperatuurbereik. Een zeer verdunde oplossing kan bijvoorbeeld een meer merkbare verandering in pH ervaren dan een geconcentreerde oplossing.
* Bufferingscapaciteit: Natriumfosfaatoplossingen vertonen een buffercapaciteit, wat betekent dat ze significante veranderingen in pH weerstaan. Dit is te wijten aan de aanwezigheid van zowel het fosfaation (PO43-) als het conjugaatzuur (HPO42-).
Samenvattend:
Hoewel de temperatuur een kleine impact heeft op de pH van natriumfosfaatoplossingen, is het meestal een secundair effect in vergelijking met de concentratie. De oplossing wordt over het algemeen iets zuurder naarmate de temperatuur toeneemt, maar de buffercapaciteit van de oplossing helpt deze verandering te minimaliseren.
 Veranderingen in steenwerktuigen kunnen laten zien hoe Mesolithische jager-verzamelaars reageerden op het veranderende klimaat
Veranderingen in steenwerktuigen kunnen laten zien hoe Mesolithische jager-verzamelaars reageerden op het veranderende klimaat  Nieuw-Zeeland onder druk stelt koolstofvrij plan op
Nieuw-Zeeland onder druk stelt koolstofvrij plan op What is Adaptation Theory?
What is Adaptation Theory?  Planet kent 10 opeenvolgende maanden van recordbrekende hitte
Planet kent 10 opeenvolgende maanden van recordbrekende hitte  Niet-duurzame zandwinning bedreigt levens langs de Mekong-rivier in Cambodja
Niet-duurzame zandwinning bedreigt levens langs de Mekong-rivier in Cambodja
Hoofdlijnen
- Waar groeit gist van nature?
- Wat is osmotische lyse?
- Welke organismen die niet hun eigen voedsel kunnen maken, zijn?
- Wat is fotosytem I en II?
- Wetenschappers onthullen superbugs-artillerie
- Kunnen bevers een chronische slopende ziekte krijgen?
- Studie biedt een model om te voorspellen hoe microbiomen op veranderingen kunnen reageren
- Een vogel in de bush is $223 waard, 851 in de hand
- Wat is de wetenschappelijke naam voor hond in Phylum?
- Het stabiliseren van emulsieonderzoek verbetert de brandbestrijding en meer

- Een stabiliserende invloed maakt de evolutie van lithium-zwavelbatterijen mogelijk
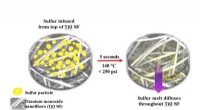
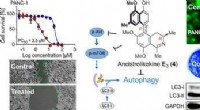
- Samenstelling van wijnstokken in het regenwoud verhongert alvleesklierkankercellen
- Metaalzepen kritisch in snelheid van bederf van olieverfschilderijen

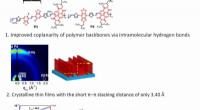
- Organische elektronica:wetenschappers ontwikkelen een hoogwaardige unipolaire n-type dunne-filmtransistor
 Verschil tussen een kompas en een gradenboog
Verschil tussen een kompas en een gradenboog  Giftige PFAS detecteren met een sensor ter grootte van een chip
Giftige PFAS detecteren met een sensor ter grootte van een chip Machine learning voorspelt black-outs veroorzaakt door stormen
Machine learning voorspelt black-outs veroorzaakt door stormen Wat wordt het minerale ion dat wordt gebruikt om eiwitten te vormen?
Wat wordt het minerale ion dat wordt gebruikt om eiwitten te vormen?  Hoeveel soorten energie zijn er?
Hoeveel soorten energie zijn er?  Waar theoretische fysica te bestuderen?
Waar theoretische fysica te bestuderen?  Lichtsnelheid door lucht in seconden?
Lichtsnelheid door lucht in seconden?  Relatie tussen frequentie en fotonergie?
Relatie tussen frequentie en fotonergie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

