
Wetenschap
Hoe verschillen ISTOPES -waterstof -2 en -3?
1. Aantal neutronen:
* waterstof-2 (deuterium): Heeft één proton en één neutronen .
* waterstof-3 (tritium): Heeft één proton en twee neutronen .
2. Atomic Mass:
* deuterium: Atomische massa van ongeveer 2 Amu (atomaire massa -eenheden).
* tritium: Atomische massa van ongeveer 3 Amu .
3. Stabiliteit:
* deuterium: stabiele isotoop , wat betekent dat het radioactief niet vervalt.
* tritium: radioactieve isotoop , wat betekent dat het in de loop van de tijd vervalt en bèta -deeltjes uitstraalt. Het heeft een halfwaardetijd van ongeveer 12,3 jaar.
4. Voorkomen in de natuur:
* deuterium: Gevonden in kleine hoeveelheden (ongeveer 0,015% van de natuurlijke waterstof).
* tritium: Natuurlijk komt voor in sporenhoeveelheden, voornamelijk gevormd door kosmische stralen die interactie hebben met de atmosfeer.
5. Gebruik:
* deuterium: Gebruikt in nucleaire fusiereacties, als tracer in biologische studies en bij de productie van zwaar water (D₂O).
* tritium: Gebruikt in lichtgevende verven voor horloges en andere apparaten, als tracer in onderzoek en in kernwapens.
Sleutelpunt: Isotopen van een element hebben hetzelfde aantal protonen (dat het element definieert) maar verschillende aantallen neutronen. Dit verschil in neutronen leidt tot de variaties in atomaire massa, stabiliteit en andere eigenschappen.
 Is de neutrale temperatuur afhankelijk van de koude verbinding?
Is de neutrale temperatuur afhankelijk van de koude verbinding?  Wat voor soort reactie is ammoniumnitraat en natriumhydroxide?
Wat voor soort reactie is ammoniumnitraat en natriumhydroxide?  Biomaterialen voor het coaten van papier, afgeleid van anaëroob korrelslib, kunnen kosteneffectief zijn
Biomaterialen voor het coaten van papier, afgeleid van anaëroob korrelslib, kunnen kosteneffectief zijn  Hoeveel zuurstofatomen zijn er in 4C12H22O11?
Hoeveel zuurstofatomen zijn er in 4C12H22O11?  Op zoek naar stabiele vloeistoffen
Op zoek naar stabiele vloeistoffen
 Wat is het zelfstandig naamwoord van bewustzijn?
Wat is het zelfstandig naamwoord van bewustzijn?  Trump probeert het klimaatbeleid van Obama te verzwakken de kolenindustrie versterken
Trump probeert het klimaatbeleid van Obama te verzwakken de kolenindustrie versterken Onderzoekers onderzoeken achteruitgang van Zuid-Afrikaanse bosvogels
Onderzoekers onderzoeken achteruitgang van Zuid-Afrikaanse bosvogels Tiny Island of Niue is 's werelds eerste Dark Sky Nation
Tiny Island of Niue is 's werelds eerste Dark Sky Nation  Koraalkwekers brengen Jamaicaanse riffen terug, stuk voor stuk
Koraalkwekers brengen Jamaicaanse riffen terug, stuk voor stuk
Hoofdlijnen
- Welk deel van cellulaire ademhaling moet plaatsvinden voordat een andere stap kan optreden?
- Wat is de buitenste laag van een menselijke rode bloedcel?
- Wat is een hypothese en hoe vorm je er een?
- Wat zijn de eenvoudigste organismen van dierenrijk?
- Welke twee mensen worden gecrediteerd voor het ontdekken van de vorm van DNA?
- Welke celorganel van dieren doet de ademhaling?
- Helder en fotostabiel groen fluorescerend eiwit afgeleid van Japanse kwallen
- Amerikaanse biologische klok-genetici winnen Nobelprijs voor Geneeskunde 2017
- Vooraf vermelden het resultaat dat kan worden verkregen uit test Een hypothese wordt wat genoemd?
- Doorbraak in actinide metaal-metaal binding
- Imperfectie is OK voor betere MOF's

- Wetenschappers fabriceren veelzijdige katalysator voor polyestersynthese en -afbraak

- Wat planten ons kunnen leren over het opruimen van olievlekken en microfluïdica

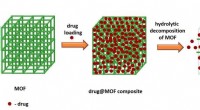
- Voeg gewoon water toe:scheikundigen suggereren een oplossing voor onoplosbare medicijnen
 Hoe verschillen Altdorfer -landschappen van Durer of Nature?
Hoe verschillen Altdorfer -landschappen van Durer of Nature?  Raket op pad, China klaar om eerste bemanning naar ruimtestation te sturen
Raket op pad, China klaar om eerste bemanning naar ruimtestation te sturen Wat is de gemiddelde snelheid van een windmolen?
Wat is de gemiddelde snelheid van een windmolen?  Samenzweringstheorieën zijn gevaarlijk, zelfs als ze het gedrag niet beïnvloeden
Samenzweringstheorieën zijn gevaarlijk, zelfs als ze het gedrag niet beïnvloeden  Een satellietbeeldvormingssysteem dat elektromagnetisch aan het oppervlak straalt en vervolgens de gereflecteerde energie registreert, is wat?
Een satellietbeeldvormingssysteem dat elektromagnetisch aan het oppervlak straalt en vervolgens de gereflecteerde energie registreert, is wat?  Wat is de sfeer buiten de sfeer?
Wat is de sfeer buiten de sfeer?  Wat zijn vier gebruik van metalen?
Wat zijn vier gebruik van metalen?  Welke vloeistof heeft het hoogste waterpotentieel?
Welke vloeistof heeft het hoogste waterpotentieel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

